
Struktura fluorku magnezu, właściwości, synteza, zastosowania
Plik fluorek magnezu jest to bezbarwna sól nieorganiczna o wzorze chemicznym MgF Mg. Występuje w naturze jako minerał sellait. Ma bardzo wysoką temperaturę topnienia i jest bardzo słabo rozpuszczalny w wodzie. Jest stosunkowo obojętny, gdyż np. Jego reakcja z kwasem siarkowym przebiega powoli i niecałkowicie oraz jest odporny na hydrolizę kwasem fluorowodorowym (HF) do 750ºC..
Jest to związek, na który promieniowanie o wysokiej energii ma niewielki wpływ. Ponadto posiada niski współczynnik załamania światła, wysoką odporność na korozję, dobrą stabilność termiczną, znaczną twardość oraz doskonałe właściwości przepuszczalności światła widzialnego, UV (ultrafioletowego) i IR (podczerwonego)..
Te właściwości sprawiają, że ma doskonałe parametry optyczne, a ponadto jest użytecznym materiałem między innymi jako nośnik katalizatora, element powłokowy, soczewki przeciwodblaskowe i okienka do transmisji podczerwieni..
Indeks artykułów
- 1 Struktura
- 2 Właściwości
- 3 Synteza i przygotowanie
- 4 Zastosowania
- 4.1 Optyka
- 4.2 Kataliza lub przyspieszenie reakcji
- 4.3 Inne zastosowania
- 5 Referencje
Struktura
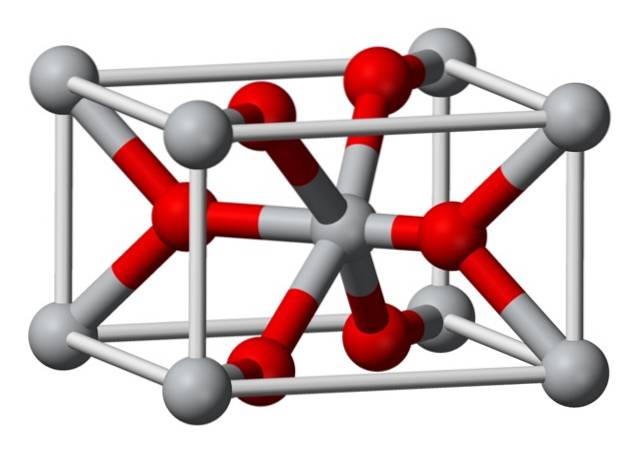
Struktura krystaliczna chemicznie otrzymanego fluorku magnezu jest tego samego typu, co struktura naturalnego minerału sellaitu. Krystalizuje w klasie dipiramidalnej układu tetragonalnego.
Jony magnezu (Mg2 +) znajdują się w centralnej tetragonalnej przestrzeni kratowej, podczas gdy jony fluorkowe (F-) znajdują się w tej samej płaszczyźnie, co ich sąsiadów Mg2 + i są z nimi powiązane, zgrupowane w parach. Odległość między jonami Mg2 + i F- wynosi 2,07 Å (angstremów) (2,07 × 10-10 m).
Jego koordynacja krystaliczna wynosi 6: 3. Oznacza to, że każdy jon Mg2 + jest otoczony przez 6 jonów F-, a każdy jon F- jest z kolei otoczony przez 3 jony Mg2 + 5..
Struktura jest bardzo podobna do mineralnego rutylu, który jest naturalną postacią dwutlenku tytanu (TiO2), z którym ma kilka wspólnych właściwości krystalograficznych..
Podczas jego produkcji fluorek magnezu nie wytrąca się jako bezpostaciowe ciało stałe, ponieważ jony Mg2 + i F- nie mają tendencji do tworzenia w roztworze kompleksów polimerowych..
Nieruchomości
Co ciekawe, fluorek magnezu jest materiałem dwójłomnym. Jest to właściwość optyczna, która umożliwia podzielenie padającego promienia światła na dwa oddzielne promienie, które rozchodzą się z różnymi prędkościami i długościami fal..
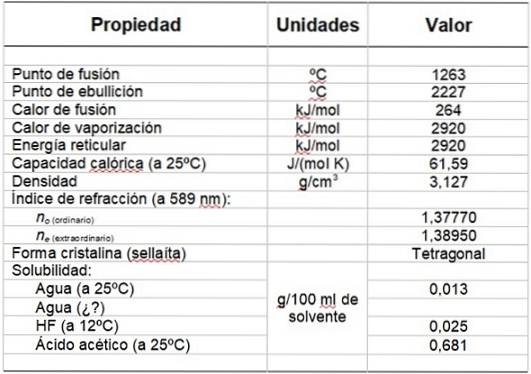
Tabela 1 przedstawia niektóre z jego właściwości.
Tabela 1. Właściwości fizyczne i chemiczne fluorku magnezu.
Synteza i przygotowanie
Można go przygotować na różne sposoby, w tym:
1-W wyniku reakcji tlenku magnezu (MgO) lub węglanu magnezu (MgCO3) z kwasem fluorowodorowym (HF) 2:
MgO + 2 HF MgF2 + H2O
MgCO3 + 2 HF MgF2 + CO2 + H2O
2-W wyniku reakcji między węglanem magnezu i wodorofluorkiem amonu (NH4HF2), obie w stanie stałym, w temperaturze między 150 a 400 ° C2:
150-400ºC
MgCO3 + NH4HF2 MgF2 + NH3 + CO2 + H2O
3-Ogrzewanie wodnego roztworu węglanu magnezu i fluorku amonu (NH4F) w obecności wodorotlenku amonu (NH4OH) w temperaturze 60 ° C 2:
60 ° C, NH4OH
MgCO3 + 3 NH4F NH4MgF3 + (NH4) 2CO3
Powstały osad fluorku magnezowo-amonowego (NH4MgF3) jest następnie ogrzewany w temperaturze 620 ° C przez 4 godziny w celu uzyskania fluorku magnezu:
620ºC
NH4MgF3 MgF2 + NH3 + HF
4-Jako produkt uboczny otrzymywania berylu (Be) i uranu (U). Fluorek żądanego pierwiastka jest podgrzewany metalicznym magnezem w tyglu pokrytym MgF2 2:
BeF2 + Mg Be + MgF2
5-reaktywny chlorek magnezu (MgCl2) z fluorkiem amonu (NH4F) w roztworze wodnym w temperaturze pokojowej 3:
25 ° C, H2O
MgCl2 + 2 NH4F MgF2 + 2NH4Cl
Ponieważ metody otrzymywania MgF2 są drogie, podejmuje się próby uzyskania go bardziej ekonomicznie, wśród których wyróżnia się sposób wytwarzania MgF2 począwszy od wody morskiej..
Charakteryzuje się dodaniem wystarczającej ilości jonów fluorkowych (F-) do wody morskiej, która ma obfite stężenie jonów magnezu (Mg2 +), sprzyjając w ten sposób wytrącaniu się MgF2..
Kryształy optyczne fluorku magnezu otrzymywane są poprzez prasowanie na gorąco wysokiej jakości proszku MgF2, otrzymywanego np. Metodą NH4HF2.
Istnieje wiele technik wytwarzania materiałów z fluorku magnezu, takich jak wzrost pojedynczych kryształów, spiekanie (prasowanie do formy lub kształtowanie) bez ciśnienia, prasowanie na gorąco i spiekanie mikrofalowe..
Aplikacje
Optyka
Kryształy MgF2 nadają się do zastosowań optycznych, ponieważ są przezroczyste od obszaru UV do środkowego obszaru IR 2.10.
Jako folia obojętna służy do zmiany właściwości przepuszczania światła materiałów optycznych i elektronicznych. Jednym z głównych zastosowań optyki VUV jest technologia eksploracji kosmosu.
Ze względu na swoją dwójłomność materiał ten jest przydatny w optyce polaryzacyjnej, w oknach i pryzmatach lasera ekscymerowego (rodzaj lasera ultrafioletowego używanego w chirurgii oka)..
Należy zauważyć, że fluorek magnezu stosowany do produkcji cienkowarstwowych materiałów optycznych musi być wolny od zanieczyszczeń lub związków będących źródłem tlenków, takich jak woda (H2O), jony wodorotlenkowe (OH-), jony węglanowe (CO3 = ), jony siarczanowe (SO4 =) i tym podobne 12.
Kataliza lub przyspieszenie reakcji
MgF2 z powodzeniem stosowany jest jako katalizator reakcji eliminacji chloru i dodatku wodoru w CFC (chlorofluorowęglowodory), znanych czynnikach chłodniczych i propelentach aerozolowych oraz odpowiada za uszkodzenie warstwy ozonowej atmosfery.
Powstałe związki, HFC (wodorofluorowęglowodory) i HCFC (wodorochlorofluorowęglowodory), nie powodują tego szkodliwego wpływu na atmosferę 5.
Jest również przydatny jako nośnik katalizatora do hydroodsiarczania (usuwania siarki) związków organicznych..
Inne zastosowania
Materiały powstałe w wyniku interkalacji grafitu, fluoru i MgF2 wykazują wysokie przewodnictwo elektryczne, dlatego zaproponowano je do stosowania w katodach oraz jako materiały elektroprzewodzące..
Eutektyka utworzona przez NaF i MgF2 ma właściwości magazynowania energii w postaci ciepła utajonego, dlatego rozważono jej zastosowanie w systemach energii słonecznej..
W dziedzinie biochemii fluorek magnezu wraz z innymi fluorkami metali jest stosowany do hamowania reakcji przenoszenia fosforylu w enzymach.
Ostatnio nanocząsteczki MgF2 zostały z powodzeniem przetestowane jako wektory dostarczania leków w chorych komórkach do leczenia raka..
Bibliografia
- Buckley, H.E. i Vernon, W.S. (1925) XCIV. Struktura krystaliczna fluorku magnezu. Philosophical Magazine Series 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology, tom 11, piąte wydanie, John Wiley & Sons. ISBN 0-471-52680-0 (wer. 11).
- Peng, Minhong; Cao, Weiping; i Song, Jinhong. (2015). Przygotowanie półprzezroczystej ceramiki MgF2 przez spiekanie na gorąco. Journal of Wuhan University of Technology-Mater: Sci. Ed. Vol. 30 nr 4.
- Непоклонов, И.С. (2011). Fluorek magnezu. Źródło: opracowanie własne.
- Wojciechowska, Maria; Zieliński Michał; i Pietrowski, Mariusz. (2003). MgF2 jako niekonwencjonalny nośnik katalizatora. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Fluorek magnezu (MgF2). Pobrane 12.07.2019 pod adresem: korth.de
- Sevonkaev, Igor i Matijevic, Egon. (2009). Tworzenie cząstek fluorku magnezu o różnych morfologiach. Langmuir 2009, 25 (18), 10534-10539.
- Непоклонов, И.С. (2013). Fluorek magnezu. Źródło: opracowanie własne.
- Tao Qin, Peng Zhang i Weiwei Qin. (2017). Nowatorska metoda syntezy tanich kulek fluorku magnezu z wody morskiej. Ceramics International 43 (2017) 14481-14483.
- Encyklopedia chemii przemysłowej Ullmanna (1996) Wydanie piąte. Tom A11. VCH Verlagsgesellschaft mbH. Nowy Jork. ISBN 0-89573-161-4 .Linki zewnętrzne.
- NASA (2013). Inżynierowie badający zwierciadło główne 8109563 Kosmicznego Teleskopu Hubble'a. Źródło: mix.msfc.nasa.gov
Jeszcze bez komentarzy