
Podstawowe cechy, rodzaje i przykłady węgla
Plik węgiel pierwotny To taki, który w każdym związku, niezależnie od środowiska molekularnego, tworzy wiązanie z co najmniej jednym innym atomem węgla. To wiązanie może być pojedyncze, podwójne (=) lub potrójne (≡), o ile tylko dwa atomy węgla są połączone i znajdują się w sąsiadujących pozycjach (logicznie).
Wodory obecne na tym węglu nazywane są wodorami pierwszorzędowymi. Jednak właściwości chemiczne pierwszorzędowych, drugorzędowych i trzeciorzędowych wodorów różnią się nieznacznie i podlegają głównie molekularnemu środowisku węgla. Z tego powodu węgiel pierwotny (1 °) jest zwykle traktowany ważniej niż jego atomy wodoru.
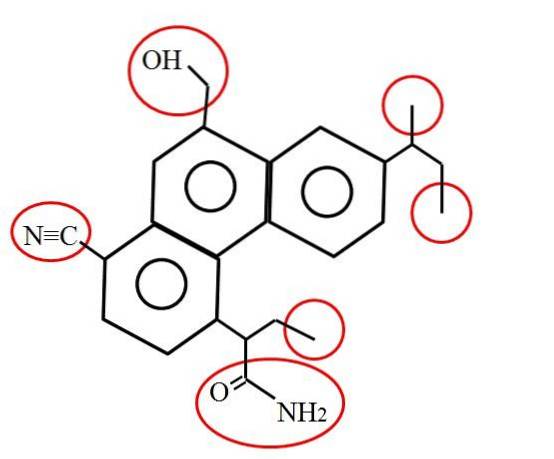
A jak wygląda pierwotny węgiel? Odpowiedź zależy, jak wspomniano, od środowiska molekularnego lub chemicznego. Na przykład powyższy obraz przedstawia węgiel pierwotny, otoczony czerwonymi okręgami, w strukturze hipotetycznej (chociaż prawdopodobnie rzeczywistej) cząsteczki..
Jeśli przyjrzysz się uważnie, zauważysz, że trzy z nich są identyczne; podczas gdy pozostałe trzy są zupełnie inne. Pierwsze trzy składają się z grup metylowych, -CH3 (po prawej stronie cząsteczki), a pozostałe to grupy metylolowe, -CHdwaOH, nitryl, -CN i amid, RCONHdwa (po lewej stronie cząsteczki i pod nią).
Indeks artykułów
- 1 Charakterystyka węgla pierwotnego
- 1.1 Lokalizacja i linki
- 1.2 Niska przeszkoda steryczna
- 1.3 Reaktywność
- 2 rodzaje
- 3 przykłady
- 3.1 Aldehydy i kwasy karboksylowe
- 3.2 W aminach liniowych
- 3.3 W halogenkach alkilowych
- 4 Odnośniki
Charakterystyka węgla pierwotnego
Lokalizacja i linki
Sześć pierwotnych węgli pokazano powyżej, bez komentarza poza ich lokalizacją i innymi atomami lub grupami, które im towarzyszą. Mogą znajdować się w dowolnym miejscu konstrukcji i gdziekolwiek się znajdują, oznaczają „koniec drogi”; to znaczy tam, gdzie kończy się fragment szkieletu. Dlatego czasami określa się je jako węgle końcowe..
Zatem jest oczywiste, że grupy -CH3 są terminalni, a ich węgiel wynosi 1 °. Zauważ, że ten węgiel wiąże się z trzema atomami wodoru (które zostały pominięte na ilustracji) i z jednym węglem, uzupełniając ich odpowiednie cztery wiązania..
Dlatego wszystkie charakteryzują się wiązaniem C-C, wiązaniem, które może być również podwójne (C = CHdwa) lub potrójny (C≡CH). Pozostaje to prawdą, nawet jeśli do tych atomów węgla są przyłączone inne atomy lub grupy; tak jak w przypadku pozostałych trzech pozostałych węgli 1 ° na obrazie.
Mała przeszkoda steryczna
Wspomniano, że węgle pierwotne są końcowe. Sygnalizując koniec odcinka szkieletu, żadne inne atomy nie zakłócają ich przestrzennie. Na przykład grupy -CH3 mogą wchodzić w interakcje z atomami innych cząsteczek; ale ich interakcje z sąsiednimi atomami tej samej cząsteczki są niskie. To samo dotyczy -CHdwaOH i -CN.
Dzieje się tak, ponieważ są one praktycznie narażone na działanie „próżni”. Dlatego generalnie wykazują niską zawadę przestrzenną w stosunku do innych rodzajów węgla (2, 3 i 4).
Są jednak wyjątki, produkt o strukturze molekularnej ze zbyt dużą liczbą podstawników, dużą elastycznością lub tendencją do zamykania się..
Reaktywność
Jedną z konsekwencji niższej zawady przestrzennej wokół pierwszego węgla jest większa ekspozycja na reakcję z innymi cząsteczkami. Im mniej atomów blokuje drogę atakującej cząsteczki do niej, tym bardziej prawdopodobne będzie jej reakcja..
Ale jest to prawdą tylko ze sterycznego punktu widzenia. Właściwie najważniejszym czynnikiem jest elektroniczny; to znaczy, jakie jest otoczenie wspomnianych węgli 1 °.
Węgiel sąsiadujący z pierwotnym przenosi na niego część swojej gęstości elektronicznej; to samo może się zdarzyć w przeciwnym kierunku, sprzyjając pewnemu typowi reakcji chemicznej.
Zatem czynniki steryczne i elektroniczne wyjaśniają, dlaczego jest on zwykle najbardziej reaktywny; chociaż tak naprawdę nie ma globalnej reguły reaktywności dla wszystkich węgli pierwotnych.
Rodzaje
Węgle pierwotne nie posiadają wewnętrznej klasyfikacji. Zamiast tego są klasyfikowane na podstawie grup atomów, do których należą lub z którymi są związane; To są grupy funkcyjne. A ponieważ każda grupa funkcyjna definiuje określony typ związku organicznego, istnieją różne węgle pierwotne.
Na przykład grupa -CHdwaOH pochodzi od pierwszorzędowego alkoholu RCHdwaO. Dlatego alkohole pierwszorzędowe składają się z 1 ° węgli połączonych z grupą hydroksylową -OH.
Z drugiej strony, grupa nitrylowa -CN lub -C≡N może być przyłączona bezpośrednio do atomu węgla tylko poprzez pojedyncze wiązanie C-CN. Zatem istnienie wtórnych nitryli (R.dwaCN) lub znacznie mniej trzeciorzędny (R.3CN).
Podobny przypadek występuje z podstawnikiem pochodzącym od amidu -CONHdwa. Może ulegać substytucjom wodorów atomu azotu; ale jego węgiel może wiązać się tylko z innym węglem i dlatego zawsze będzie uważany za pierwszorzędowy, C-CONHdwa.
A w odniesieniu do grupy -CH3, Jest to podstawnik alkilu, który może wiązać się tylko z innym węglem, dlatego jest pierwszorzędowy. Jeśli rozważa się grupę etylową, -CHdwaCH3, natychmiast zauważysz, że CHdwa, grupa metylenowa jest atomem węgla 2 °, ponieważ jest połączona z dwoma atomami węgla (C-CHdwaCH3).
Przykłady
Aldehydy i kwasy karboksylowe
Wspomniano o kilku przykładach węgla pierwotnego. Oprócz nich istnieje następująca para grup: -CHO i -COOH, zwane odpowiednio formylami i karboksylami. Węgle z tych dwóch grup są pierwszorzędowe, ponieważ zawsze będą tworzyć związki o wzorach RCHO (aldehydy) i RCOOH (kwasy karboksylowe).
Ta para jest ściśle ze sobą spokrewniona ze względu na reakcje utleniania, którym podlega grupa formylowa, która przekształca się w karboksyl:
RCHO => RCOOH
Reakcja aldehydów lub grupy -CHO, jeśli występuje jako podstawnik w cząsteczce.
W aminach liniowych
Klasyfikacja amin zależy wyłącznie od stopnia podstawienia wodorów z grupy -NHdwa. Jednak w aminach liniowych można zaobserwować węgle pierwszorzędowe, tak jak w propanoaminie:
CH3-CHdwa-CHdwa-NHdwa
Zwróć uwagę, że CH3 zawsze będzie to pierwszy węgiel, ale tym razem CHdwa po prawej stronie jest również 1 °, ponieważ jest związany z pojedynczym atomem węgla i grupą NHdwa.
W halogenkach alkilowych
Przykład bardzo podobny do poprzedniego podano dla halogenków alkilu (i wielu innych związków organicznych). Załóżmy, że bromopropan:
CH3-CHdwa-CHdwa-Br
W nim pierwotne węgle pozostają takie same.
Podsumowując, węgle 1 ° wykraczają poza typ związku organicznego (a nawet metaloorganicznego), ponieważ mogą być obecne w każdym z nich i są identyfikowane po prostu dlatego, że są połączone z pojedynczym węglem.
Bibliografia
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (10th wydanie.). Wiley plus.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Morrison, R. T. and Boyd, R. N. (1987). Chemia organiczna. (5ta Wydanie). Od redakcji Addison-Wesley Interamericana.
- Ashenhurst J. (16 czerwca 2010). Pierwotne, drugorzędne, trzeciorzędowe, czwartorzędowe w chemii organicznej. Magister chemii organicznej. Odzyskane z: masterorganicchemistry.com
- Wikipedia. (2019). Węgiel pierwotny. Odzyskane z: en.wikipedia.org

Jeszcze bez komentarzy