
Struktura, właściwości, zastosowanie fosforanu potasu (K3PO4)
Plik Fosforan potasu jest związkiem nieorganicznym utworzonym przez trzy jony potasu K.+ i jon fosforanowy PO43-. Jego wzór chemiczny to K.3PO4. Jest to bezbarwna lub biała krystaliczna substancja stała. Jest bardzo dobrze rozpuszczalny w wodzie, tworząc roztwory alkaliczne, czyli z wieloma jonami OH-, stąd zasadowe pH.
Jon fosforanowy pełni w komórkach ważną funkcję związaną z magazynowaniem energii. Fosforan potasu jest szeroko stosowany w reakcjach chemii organicznej, gdzie może działać jako zasada, czyli przyjmować protony H.+. Może również działać jako katalizator lub przyspieszacz niektórych reakcji.

Został użyty w celu zmniejszenia ataku niektórych owadów na rośliny pszenicy, ponieważ czyni je bardziej odpornymi na te rośliny. Jednak zaobserwowano, że sprzyja to wydzielaniu się metanu (CH4), gaz cieplarniany z mikrokultur ryżu.
Jest stosowany jako środek przeczyszczający, między innymi w celu wydłużenia czasu znieczulenia miejscowego, zatrzymania ubytków i pomocy w powlekaniu powierzchni..
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Gęstość
- 3.5 Rozpuszczalność
- 3,6 pH
- 3.7 Właściwości chemiczne
- 3.8 Inne właściwości
- 3.9 Rola fosforanów w organizmie człowieka
- 4 Otrzymywanie
- 5 zastosowań
- 5.1 Jako podstawa w reakcjach chemii organicznej
- 5.2 Jako katalizator
- 5.3 W rolnictwie
- 5.4 W zastosowaniach medycznych
- 5.5 Jako środek przeczyszczający
- 5.6 W weterynarii
- 5.7 W uzyskiwaniu DNA
- 5.8 W różnych zastosowaniach
- 5.9 Negatywny aspekt stosowania w rolnictwie
- 6 Odnośniki
Struktura
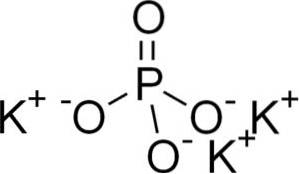
Fosforan potasu składa się z trzech kationów potasowych K.+ i anion fosforanowy PO43-.
Jon fosforanowy PO43- Składa się z jednego atomu fosforu (P) i czterech atomów tlenu (O), przy czym fosfor ma stopień utlenienia +5, a tlen ma wartościowość -2.
Nomenklatura
- Fosforan potasu
- Fosforan tripotasowy
- Fosforan potasu, trójzasadowy
- Ortofosforan tripotasowy
Nieruchomości
Stan fizyczny
Bezbarwne lub białe krystaliczne ciało stałe.
Waga molekularna
212,27 g / mol
Temperatura topnienia
1340 ºC
Gęstość
2564 g / cm3
Rozpuszczalność
Bardzo dobrze rozpuszczalny w wodzie: 106 g / 100 g wody o temp. 25 ° C. Nierozpuszczalny w etanolu.
pH
Roztwór z 1% K3PO4 ma pH 11,5-12,3.
Właściwości chemiczne
Po rozpuszczeniu w wodzie fosforan potasu rozdziela się na trzy kationy potasu K.+ i anion fosforanowy PO43-. Anion fosforanowy pobiera proton z wody i tworzy się anion wodorofosforanowy HPO4dwa-. Ten z kolei pobiera z wody kolejny proton i staje się anionem diwodorofosforanowym H.dwaPO4-.
PO43- + H.dwaO ⇔ HPO4dwa- + O-
HPO4dwa- + H.dwaO ⇔ HdwaPO4- + O-
Gdy powstają jony OH- wodny roztwór staje się zasadowy.
Inne właściwości
Oprócz postaci bezwodnej (bez wody) ma kilka form uwodnionych; oznacza to, że cząsteczka K.3PO4 może towarzyszyć jedna lub więcej cząsteczek wody w strukturze krystalicznej.
Z tego powodu może tworzyć na przykład monohydrat K3PO4.H.dwaLub trójwodzian K3PO4.3HdwaLub heptahydrat i nieonahydrat.
Rola fosforanów w organizmie człowieka
Jon fosforanowy PO43- jest to najbardziej rozpowszechniony anion w komórkach i odgrywa ważną rolę w magazynowaniu energii.
Jon fosforanowy uczestniczy również w tworzeniu i odżywianiu kości i zębów, ponieważ reguluje stężenie wapnia w surowicy krwi oraz w licznych reakcjach przenoszenia energii w komórce..
Otrzymywanie
Fosforan potasu można otrzymać wychodząc z reakcji chlorku potasu KCl i fosforanu amonu (NH4)3PO4.
Chlorek potasu + fosforan amonu → fosforan potasu + chlorek amonu
3 KCl + (NH4)3PO4 → K.3PO4 + 3 NH4Cl
Aplikacje
Jako podstawa w reakcjach chemii organicznej
Fosforan potasu K3PO4 Był używany w różnych reakcjach chemii organicznej. Na przykład służy do syntezy acetylenów wychodząc ze związków dibromowanych..
W tej syntezie zachodzi dehydrobrominacja (eliminacja wodoru i bromu), w której K3PO4 bezwodne ciało stałe (bez wody) działa jak miękka podstawa i pobiera dwa protony z cząsteczki, dwa atomy bromu są usuwane i uzyskuje się odpowiedni acetylen.
do6H.5-CHBr-CHdwaBr + 2 K.3PO4 → C6H.5-C≡CH + 2 KBr + 2 K.dwaHPO4

Jako katalizator
K3PO4 służy jako katalizator w różnych reakcjach chemii organicznej. Na przykład był używany jako ciało stałe do otrzymywania biodiesla ze zużytego oleju do smażenia..
Biodiesel jest paliwem podobnym do oleju napędowego, ale otrzymywanym z tłuszczów lub olejów naturalnych lub nie.
Fosforan potasu był skuteczniejszy jako katalizator lub przyspieszacz tej reakcji niż fosforan sodu Na3PO4 i tlenek wapnia CaO.
W rolnictwie
K3PO4 został użyty do traktowania roślin pszenicy i uodpornienia ich na niektóre szkodniki.

Niektórzy badacze traktowali sadzonki pszenicy fosforanem potasu i okazało się, że wywołuje on odporność na mszyce. Diuraphis noxia, owad atakujący te rośliny.
Po nałożeniu rozcieńczonego roztworu K3PO4 na sadzonkach zaobserwowano mniejsze nasilenie objawów wywoływanych przez te owady oraz zmniejszenie liczby żerujących na nich mszyc.

W zastosowaniach medycznych
Fosforan potasu został użyty do zmiany znieczulającego działania lidokainy, środka miejscowo znieczulającego. Środek znieczulający miejscowo to lek, który po zastosowaniu na dany obszar ciała powoduje utratę wrażliwości na ból w tym obszarze..
Stwierdzono, że K3PO4 pozwala na przedłużenie miejscowego znieczulenia lidokainy.
Jako środek przeczyszczający
Fosforan potasu zwiększa płynność treści jelitowej, ponieważ pomaga zatrzymać wodę w jelicie, co pośrednio wywołuje skurcz mięśni jelit.
W weterynarii
K3PO4 jest stosowany u zwierząt z cukrzycową kwasicą ketonową (powikłaniem cukrzycy) w leczeniu hipofosfatemii (małej ilości fosforanów we krwi).
Jednak podany w nadmiarze może powodować hipokalcemię (niski poziom wapnia we krwi), hiperfosfatemię (nadmiar fosforanów we krwi), mimowolne skurcze mięśni, mineralizację tkanek miękkich i niewydolność nerek..
Uzyskanie DNA
Fosforan potasu był używany jako bufor do oczyszczania DNA w laboratoriach genetycznych.
DNA jest białkiem występującym w komórkach i zawiera wszystkie informacje genetyczne niezbędne do rozwoju i funkcjonowania istot żywych..
Izolując DNA, naukowcy zagłębiają się w badanie przekazywania cech dziedzicznych, dlatego fosforan potasu jest bardzo pomocny.
W różnych zastosowaniach
Fosforan potasu K3PO4 służy:
- jako suplement diety,
- do wymiany elektrolitu,
- jako bufor, czyli jako układ chemiczny umożliwiający kontrolowanie poziomu jonów OH- lub wodór H.+ w roztworze wodnym,
- spowolnić lub zahamować próchnicę,
- jako inhibitor korozji i środek przeciwporostowy,
- jako środek do obróbki powierzchni i środek powlekający,
- jako środek przeciw zamarzaniu,
- w środkach czystości.

Negatywny aspekt stosowania w rolnictwie
Niektórzy badacze odkryli, że dodanie K.3PO4 Mikrokultura ryżu zwiększa emisję metanu (CH4) do atmosfery. Metan to gaz, który przyczynia się do efektu cieplarnianego i podwyższa temperaturę naszej planety.
Bibliografia
- NAS. National Library of Medicine. (2019). Fosforan potasu. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Panciera, D.L. (2012). Terapia płynami w zaburzeniach endokrynologicznych i metabolicznych. Suplementacja fosforu. W zaburzeniach płynów, elektrolitów i kwasowo-zasadowych w praktyce małych zwierząt (wydanie czwarte). Odzyskany z sciencedirect.com.
- Shenawi-Khalil, S. i in. (2012). Synteza acetylenów poprzez dehydrobromowanie z użyciem stałego bezwodnego fosforanu potasu jako zasady w warunkach przeniesienia fazowego. Tetrahedron Letters, tom 53, wydanie 18, 2012, strony 2295-2297. Odzyskany z sciencedirect.com.
- Guan, G. i in. (2009). Fosforan trójpotasowy jako stały katalizator do produkcji biodiesla ze zużytego oleju jadalnego. Technologia przetwarzania paliwa, tom 90, wydanie 4, 2009, strony 520-524. Odzyskany z sciencedirect.com.
- Mgr Kulkami (2012). Mechanistyczne podejście do szybkiej i bezrozpuszczalnikowej syntezy α-hydroksyfosfonianów z użyciem fosforanu potasu jako katalizatora. Comptes Rendus Chimie, tom 16, wydanie 2, 2013, strony 148-152. Odzyskany z sciencedirect.com.
- Venter, E. i in. (2014). Fosforan potasu wywołuje tolerancję na rosyjską mszycę pszenną (Diuraphis noxia, Homoptera: Aphididae) na pszenicy. Crop Protection tom 61, lipiec 2014, strony 43-50. Odzyskany z sciencedirect.com.
- Bonturi, N. i in. (2013). Cytrynian sodu i fosforan potasu jako alternatywne bufory adsorpcyjne w hydrofobowym i aromatycznym tiofilowym oczyszczaniu plazmidowego DNA ze zneutralizowanego lizatu za pomocą chromatografii. Journal of Chromatography B, tomy 919-920, 2013, strony 67-74. Odzyskany z sciencedirect.com.
- Conrad, R. i Klose, M. (2005). Wpływ nawożenia fosforanem potasu na produkcję i emisję metanu i jego 13C-stabilny skład izotopów w mikrokosmosie ryżu. Soil Biology and Biochemistry, tom 37, wydanie 11, 2005, strony 2099-2108. Odzyskany z sciencedirect.com.
- Lide, D.R. (redaktor) (2003). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- Smokefoot. (2019). Fosforan tripotasowy. Odzyskany z en.wikipedia.org


Jeszcze bez komentarzy