
Struktura fosforku glinu (AIP), właściwości, zastosowania, zagrożenia
Plik fosforek glinu Jest to związek nieorganiczny utworzony przez atom glinu (Al) i atom fosforu (P). Jego wzór chemiczny to AlP. Jest to jednolicie ciemnoszary lub, jeśli jest bardzo czysty, żółty. Jest to niezwykle toksyczny związek dla istot żywych.
Fosforan glinu reaguje z wilgocią, tworząc fosfinę lub fosfan PH3, który jest trującym gazem. Z tego powodu AlP nie może mieć kontaktu z wodą. Silnie reaguje z kwasami i roztworami alkalicznymi.

W przeszłości był używany do eliminowania szkodników, takich jak owady i gryzonie, w miejscach przechowywania ziarna zbóż i innych produktów rolnych. Jednak ze względu na duże zagrożenie został zakazany w większości krajów świata..
Obecnie teoretycznie badana jest jego przydatność w dziedzinie elektroniki za pomocą komputerów obliczających możliwość otrzymania półprzewodnikowych nanorurek AlP, czyli ekstremalnie małych rur, które mogą przesyłać energię elektryczną tylko w określonych warunkach..
Fosforan glinu jest bardzo niebezpiecznym związkiem, dlatego należy obchodzić się z nim za pomocą środków bezpieczeństwa, takich jak rękawice, okulary, maski i odzież ochronna..
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Gęstość
- 3.5 Rozpuszczalność
- 3.6 Właściwości chemiczne
- 3.7 Inne właściwości
- 4 Otrzymywanie
- 5 zastosowań
- 5.1 W eliminacji szkodników (stosowanie zaprzestane)
- 5.2 W innych aplikacjach
- 6 Teoretyczne badanie nanorurek AlP
- 6.1 Nanorurki AlP z borem
- 6.2 Nanorurki AlP o zmienionej strukturze
- 7 Ryzyka
- 8 Odniesienia
Struktura
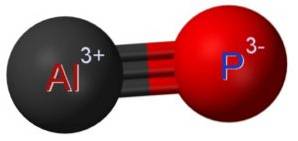
Fosforek glinu AlP powstaje w wyniku połączenia atomu glinu Al i atomu fosforu P. Wiązanie między nimi jest kowalencyjne i potrójne, dlatego jest bardzo silne.
Aluminium w AlP ma stopień utlenienia +3, a fosfor ma wartościowość -3.
Nomenklatura
- Fosforek glinu
Nieruchomości
Stan fizyczny
Ciemnoszara lub ciemnożółta lub zielona krystaliczna substancja stała. Sześcienne kryształy.
Waga molekularna
57,9553 g / mol
Temperatura topnienia
2550 ºC
Gęstość
2,40 g / cm3 w 25 ° C
Rozpuszczalność
Rozkłada się w wodzie.
Właściwości chemiczne
Reaguje z wilgocią, dając pH fosfiny lub fosfanu3 który jest łatwopalnym i trującym związkiem. Fosfina lub fosfan zapalają się samorzutnie w kontakcie z powietrzem, chyba że występuje nadmiar wody.
Reakcja fosforku glinu z wodą wygląda następująco:
Fosforan glinu + Woda → Wodorotlenek glinu + Fosfina
AlP + 3 H.dwaO → Al (OH)3 + PH3↑
Prezentacje handlowe zawierają węglan glinu Aldwa(WSPÓŁ3)3 aby zapobiec samozapłonowi fosfiny, które występuje, gdy AlP wchodzi w kontakt z wilgocią zawartą w powietrzu.
AlP jest stabilny po wyschnięciu. Reaguje gwałtownie z kwasami i roztworami alkalicznymi.
Fosforan glinu AlP nie topi się, nie sublimuje ani nie rozkłada termicznie w temperaturach do 1000 ° C. Nawet w tej temperaturze jego prężność pary jest bardzo niska, to znaczy nie paruje w tej temperaturze..
Po podgrzaniu w celu rozkładu wydziela toksyczne tlenki fosforu. W kontakcie z metalami może wydzielać palne gazy wodórdwa.
Inne właściwości
Czysty ma żółtawe zabarwienie, zmieszany z pozostałościami po reakcji preparatu przyjmuje kolor od szarego do czarnego..
Jego niska lotność wyklucza jego zapach, więc zapach czosnku, który czasami wydziela, jest spowodowany fosfiną PH3 który tworzy się w obecności wilgoci.
Otrzymywanie
Fosforek glinu można otrzymać przez ogrzewanie mieszaniny sproszkowanego metalicznego aluminium (Al) i czerwonego pierwiastka luminoforu (P).
Ze względu na powinowactwo fosforu (P) do tlenu (Odwa) i aluminium (Al) przez tlen i azot (Ndwa), reakcję należy prowadzić w atmosferze wolnej od tych gazów, na przykład w atmosferze wodoru (Hdwa) lub gaz ziemny.
Reakcję rozpoczyna się od szybkiego podgrzania strefy mieszaniny, aż do rozpoczęcia reakcji, która jest egzotermiczna (podczas reakcji wytwarzane jest ciepło). Od tego momentu reakcja przebiega szybko.
Aluminium + Fosfor → Fosforan glinu
4 Al + P4 → 4 AlP
Aplikacje
W eliminacji szkodników (zaprzestane stosowanie)
Fosforek glinu był używany w przeszłości jako środek owadobójczy i zabijający gryzonie. Jednak, chociaż został zakazany ze względu na swoją toksyczność, nadal jest używany w niektórych częściach świata..
Służy do fumigacji w pomieszczeniach zamkniętych, w których znajdują się przetworzone lub nieprzetworzone produkty rolno-spożywcze (np. Zboża), pasze dla zwierząt i produkty niespożywcze.
Celem jest zwalczanie owadów i gryzoni, które atakują przechowywane przedmioty, niezależnie od tego, czy są jadalne, czy nie..
Pozwala zwalczać gryzonie i owady na terenach niezamieszkanych, rolniczych lub nierolniczych, opryskiwać na zewnątrz lub w ich norach i gniazdach, aby zapobiec przenoszeniu przez nie niektórych chorób.


Jego forma użycia polega na wystawieniu AlP na działanie powietrza lub wilgoci, ponieważ uwalniane jest fosfina lub fosforan PH.3 które uszkadzają wiele organów zwalczanego szkodnika.

W innych aplikacjach
Fosforan glinu AlP jest używany jako źródło fosfiny lub fosfanu PH3 i jest używany w badaniach półprzewodników.
Teoretyczne badanie nanorurek AlP
Przeprowadzono badania teoretyczne dotyczące tworzenia nanorurek z fosforku glinu AlP. Nanorurki to bardzo małe i bardzo cienkie cylindry, które można zobaczyć tylko pod mikroskopem elektronowym..
Nanorurki AlP z borem
Badania teoretyczne przeprowadzone za pomocą obliczeń obliczeniowych pokazują, że zanieczyszczenia, które mogłyby zostać dodane do nanorurek AlP, mogą zmienić teoretyczne właściwości tych nanorurek..
Na przykład szacuje się, że dodanie atomów boru (B) do nanorurek AlP może zmienić je w półprzewodnikowe-p. Półprzewodnik to materiał, który zachowuje się jak przewodnik prądu elektrycznego lub jako izolator w zależności od pola elektrycznego, któremu jest poddany.
I typ półprzewodnikowy-p To wtedy do materiału dodawane są zanieczyszczenia, w tym przypadku AlP jest materiałem wyjściowym, a atomy boru byłyby zanieczyszczeniami. Półprzewodniki są przydatne w zastosowaniach elektronicznych.
Nanorurki AlP o zmienionej strukturze
Niektórzy naukowcy przeprowadzili obliczenia, aby określić wpływ zmiany struktury sieci krystalicznej nanorurek AlP z heksagonalnej na oktaedryczną..
Odkryli, że manipulowanie strukturą sieci krystalicznej może posłużyć do precyzyjnego dostrojenia przewodnictwa i reaktywności nanorurek AlP i zaprojektowania ich tak, aby były użyteczne w zastosowaniach elektronicznych i optycznych..
Ryzyka
Kontakt z fosforanem glinu może podrażniać skórę, oczy i błony śluzowe. W przypadku połknięcia lub wdychania jest toksyczny. Może być wchłaniany przez skórę z efektem toksycznym.
Jeśli AlP wejdzie w kontakt z wodą, reaguje i tworzy fosfinę lub fosfan PH3 który jest wyjątkowo łatwopalny, ponieważ zapala się w kontakcie z powietrzem. Dlatego może eksplodować. Ponadto fosfina powoduje śmierć ludzi i zwierząt.
Ponieważ fosforek glinu jest niedrogim pestycydem, jego stosowanie jest częstą przyczyną zatruć ludzi i powoduje wysoką śmiertelność.

Reaguje z wilgocią błon śluzowych i kwasem solnym HCl w żołądku, tworząc bardzo toksyczny gaz fosforanowy PH3. Dlatego przy wdychaniu i spożyciu w organizmie tworzy się fosfina, która ma śmiertelne skutki..
Jego połknięcie powoduje krwawienie z przewodu pokarmowego, zapaść sercowo-naczyniową, zaburzenia neuropsychiatryczne, niewydolność oddechową i nerek w ciągu kilku godzin..
AlP jest bardzo toksyczny dla wszystkich zwierząt lądowych i wodnych.
Bibliografia
- NAS. National Library of Medicine. (2019). Fosforek glinu. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Sjögren, B. i in. (2007). Aluminium. Inne związki glinu. W Handbook on the Toxicology of Metals (wydanie trzecie). Odzyskany z sciencedirect.com.
- Gupta, R.C. i Crissman, J.W. (2013). Ocena bezpieczeństwa, w tym bieżące i pojawiające się problemy w patologii toksykologicznej. Ryzyko ludzkie. W Handbook of Toxicology Pathology Hascheka i Rousseaux (wydanie trzecie). Odzyskany z sciencedirect.com.
- White, W.E. i Bushey, A.H. (1944). Fosforan glinu - przygotowanie i skład. Journal of The American Chemical Society 1944, 66, 10, 1666-1672. Odzyskany z pubs.acs.org.
- Mirzaei, Maryam i Mirzaei, Mahmoud. (2011). Teoretyczne badanie nanorurek z fosforku glinu domieszkowanych borem. Chemia obliczeniowa i teoretyczna 963 (2011) 294-297. Odzyskany z sciencedirect.com.
- Takahashi, L. i Takahashi, K. (2018). Dostrajanie struktury elektronicznej nanorurki z fosforku glinu poprzez konfigurację geometrii kraty. ACS Appl. Nano Mater. 2018, 1, 501-504. Odzyskany z pubs.acs.org.
- Gupta, P.K. (2016). Toksyczne działanie pestycydów (agrochemikaliów). Fosforan glinu. W Podstawach toksykologii. Odzyskany z sciencedirect.com.



Jeszcze bez komentarzy