
Cykliczne powstawanie i degradacja GMP, budowa, funkcje

Plik Cykliczne GMP, znany również jako cykliczny monofosforan guanozyny, cykliczny monofosforan guanozyny lub 3 ', 5'-monofosforan guanozyny, jest cyklicznym nukleotydem biorącym udział w wielu procesach komórkowych, zwłaszcza związanych z sygnalizacją i komunikacją wewnątrzkomórkową.
Po raz pierwszy został opisany ponad 40 lat temu, krótko po odkryciu jego analogu, cyklicznego AMP, który różni się od niego zasadą azotową, ponieważ nie jest nukleotydem guaniny, ale adeniny..
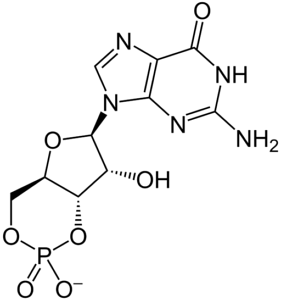
Podobnie jak inne cykliczne nukleotydy, takie jak wspomniany cykliczny AMP lub cykliczny CTP (cykliczny monofosforan cytydyny), struktura cyklicznego GMP decyduje o jego właściwościach chemicznych i aktywności biologicznej, a także czyni go bardziej stabilnym niż jego odpowiednik..
Ten nukleotyd jest wytwarzany przez enzym znany jako cyklaza guanylowa i jest zdolny do wyzwalania kaskad sygnałowych zależnych od cyklicznie kinaz białkowych GMP, podobnie jak cykliczne AMP..
Został opisany nie tylko u ssaków, które są zwierzętami bardzo złożonymi, ale także u najprostszych prokariotów, należących do królestw eubakterii i archeonów. Jego obecność w roślinach jest nadal przedmiotem dyskusji, ale dowody sugerują, że nie występuje w tych organizmach..
Indeks artykułów
- 1 Formacja i degradacja
- 2 Struktura
- 3 Funkcje
- 4 Odnośniki
Formacja i degradacja
Wewnątrzkomórkowe stężenie cyklicznych nukleotydów guaniny, jak również adeniny, jest wyjątkowo niskie, zwłaszcza w porównaniu z jej niecyklicznymi analogami, które są mono-, di- lub trifosforanami..
Jednak poziomy tego nukleotydu mogą być selektywnie zmieniane w obecności pewnych bodźców hormonalnych i innych czynników, które zachowują się jak pierwotne przekaźniki..
Metabolizm cyklicznego GMP jest częściowo niezależny od metabolizmu cyklicznego AMP i innych analogicznych nukleotydów. Jest on wytwarzany z GTP przez system enzymatyczny znany jako cyklaza guanylowa lub cyklaza guanylanowa, który jest enzymem częściowo rozpuszczalnym w większości tkanek.
Enzymy cyklazy guanylanowej są odpowiedzialne za „cyklizację” grupy fosforanowej w pozycji 5 'reszty cukrowej (rybozy), powodując wiązanie tego samego fosforanu z dwiema różnymi grupami OH w tej samej cząsteczce.
Enzym ten występuje bardzo obficie w jelicie cienkim i płucach ssaków, a najbardziej aktywne źródło znajduje się w nasieniu gatunku jeżowca morskiego. We wszystkich badanych organizmach zależy od dwuwartościowych jonów manganu, co odróżnia go od cyklaz adenylanowych, które są zależne od magnezu lub cynku..
W cyklicznej degradacji GMP pośredniczą fosfodiesterazy cyklicznych nukleotydów, które nie wydają się być specyficzne, ponieważ wykazano, że te same enzymy są zdolne do wykorzystywania zarówno cyklicznego AMP, jak i cyklicznego GMP jako hydrolizowalnych substratów..
Oba procesy, powstawanie i degradacja, są dokładnie kontrolowane wewnątrzkomórkowo..
Struktura
Struktura cyklicznego GMP nie różni się znacząco od struktury innych cyklicznych nukleotydów. Jak sama nazwa wskazuje (3 ', 5'-monofosforan guanozyny) ma grupę fosforanową przyłączoną do tlenu na węglu w pozycji 5' cukru rybozy.
Wspomniany cukier rybozowy jest jednocześnie połączony z zasadą azotową pierścienia heterocyklicznego guaniny za pomocą wiązania glikozydowego z węglem w pozycji 1 'rybozy..
Grupa fosforanowa, która jest przyłączona do atomu tlenu w pozycji 5 'rybozy, jest skondensowana w przeł poprzez wiązanie fosfodiestrowe, które występuje między tą samą grupą fosforanową a atomem węgla w pozycji 3 'rybozy, tworząc w ten sposób 3'-5'- "fosforantrans-fused " (z angielskiego 3'-5 '-przeł-stopiony fosforan).
Fuzja grupy fosforanowej lub jej „cyklizacja” powoduje wzrost sztywności cząsteczki, ponieważ ogranicza swobodną rotację wiązań w pierścieniu furanowym rybozy..
Podobnie jak w przypadku cyklicznego AMP, wiązanie glikozydowe między pierścieniem guaniny a rybozą i jego swoboda rotacji są ważnymi parametrami strukturalnymi dla specyficznego rozpoznawania cyklicznego GMP..
funkcje
W przeciwieństwie do wielu i bardzo zróżnicowanych funkcji, które mają inne analogiczne cykliczne nukleotydy, takie jak cykliczne AMP, funkcja cyklicznego GMP jest nieco bardziej ograniczona:
1-Uczestniczy w procesach sygnalizacyjnych w odpowiedzi na świetlną stymulację barwników wzrokowych. Jego stężenie jest modyfikowane w wyniku aktywacji białka G, które odbiera bodziec świetlny i oddziałuje z zależną cykliczną fosfodiesterazy GMP.
Zmiany w poziomach tego nukleotydu zmieniają przepuszczalność błony komórek gałki ocznej w kształcie pręcika na jony sodu, co powoduje inne zmiany, które przerywają przekazywanie bodźca do nerwu wzrokowego.
2-Działa w cyklu skurczu i rozluźnienia mięśni gładkich w odpowiedzi na tlenek azotu i inne związki chemiczne o różnym charakterze.
3-Wzrost jego stężenia w wyniku odpowiedzi na peptydy natriuretyczne związany jest z regulacją ruchu jonów sodu i wody przez błony komórkowe.
4-W niektórych organizmach cykliczne GMP może konkurować z cyklicznym AMP o cykliczną fosfodiesterazy nukleotydów, a dodanie cyklicznego GMP może przyczynić się do wzrostu stężenia cyklicznego AMP poprzez zmniejszenie jego degradacji.
5-Bakterie podobne E coli zwiększają swoje poziomy cyklicznego GMP po wystawieniu na chemo-atraktanty, co wskazuje, że ten nukleotyd bierze udział w procesach sygnalizacyjnych w odpowiedzi na te bodźce chemiczne.
6-Stwierdzono, że cykliczna GMP ma również ważne implikacje w procesach rozszerzenia naczyń i erekcji u ssaków.
7-Wiele kanałów jonowych bramek (wapń i sód) jest regulowanych przez wewnątrzkomórkowe ligandy, które specyficznie wykorzystują cykliczne GMP.
Bibliografia
- Botsford, J. L. (1981). Cykliczne nukleotydy u prokariotów. Recenzje mikrobiologiczne, Cztery pięć(4), 620-642.
- Garrett, R. i Grisham, C. (2010). Biochemia (4. wyd.). Boston, USA: Brooks / Cole. CENGAGE Learning.
- Hardman, J., Robison, A. i Sutherland, E. (1971). Cykliczne nukleotydy. Coroczne przeglądy fizjologiczne, 33, 311-336.
- Nelson, D. L. i Cox, M. M. (2009). Zasady Lehningera biochemii. Wydania Omega (Wyd. 5).
- Newton, R. P. i Smith, C. J. (2004). Cykliczne nukleotydy. Fitochemia, 65, 2423-2437.



Jeszcze bez komentarzy