
Historia, właściwości, struktura, zagrożenia, zastosowania helu
Plik hel jest pierwiastkiem chemicznym, którego symbolem jest On. Jest to pierwszy gaz szlachetny w układzie okresowym i zwykle znajduje się skrajnie po prawej stronie. W normalnych warunkach jest to gaz obojętny, ponieważ żaden z jego nielicznych związków nie jest stabilny; Bardzo szybko się również rozszerza i jest substancją o najniższej ze wszystkich temperatur wrzenia.
Na popularnym poziomie jest to dobrze znany gaz, ponieważ na niezliczonych imprezach lub przyjęciach dla dzieci często obserwuje się, jak balon unosi się, aż ginie na niebie. Jednak to, co naprawdę i na zawsze jest stracone w rogach Układu Słonecznego i poza nim, to atomy helu, które są uwalniane, gdy balon eksploduje lub opróżni się..

W rzeczywistości są tacy, którzy i nie bez powodu uważają, że balony z helem stanowią niewłaściwą praktykę dla tego gazu. Na szczęście ma ważniejsze i ciekawsze zastosowania, dzięki swoim właściwościom fizycznym i chemicznym, które odróżniają go od innych pierwiastków chemicznych..
Na przykład ciekły hel jest tak zimny, że może zamrozić wszystko, na przykład stop metalu, zamieniając go w materiał nadprzewodzący. Podobnie jest to ciecz, która przejawia nadciekłość, zdolną do wspinania się po ściankach szklanego pojemnika..
Swoją nazwę zawdzięcza temu, że po raz pierwszy została zidentyfikowana na Słońcu, a nie na Ziemi. Jest drugim najbardziej rozpowszechnionym pierwiastkiem we Wszechświecie i chociaż jego stężenie w skorupie ziemskiej jest znikome, można go pozyskać z rezerw gazu ziemnego i radioaktywnych minerałów uranu i toru..
Tutaj hel demonstruje kolejny ciekawy fakt: jest to gaz, który jest znacznie bardziej obfity w podłożu niż w atmosferze, gdzie ostatecznie ucieka z Ziemi i jej pola grawitacyjnego..
Indeks artykułów
- 1 Historia
- 2 Właściwości fizyczne i chemiczne
- 2.1 Wygląd
- 2.2 Liczba atomowa (Z)
- 2.3 Masa molowa
- 2.4 Temperatura topnienia
- 2.5 Temperatura wrzenia
- 2.6 Gęstość
- 2.7 Punkt potrójny
- 2.8 Punkt krytyczny
- 2.9 Ciepło topnienia
- 2.10 Ciepło parowania
- 2.11 Molowa pojemność cieplna
- 2.12 Prężność par
- 2.13 Energie jonizacji
- 2.14 Rozpuszczalność
- 2.15 Reaktywność
- 2,16 stopień utlenienia
- 3 Struktura i konfiguracja elektroniczna
- 3.1 Dimery
- 3.2 Hel II
- 3.3 Kryształy
- 4 Gdzie znaleźć i otrzymać
- 4.1 Kosmos i skały
- 4.2 Powietrze i morze
- 4.3 Skraplanie i destylacja gazu ziemnego
- 5 izotopów
- 6 Ryzyka
- 7 zastosowań
- 7.1 Systemy ciśnieniowe i odpowietrzające
- 7.2 Detekcja wycieków
- 7.3 Gaz nośny
- 7.4 Balony i sterowce
- 7.5 Nurkowanie
- 7.6 Spoiny łukowe
- 7.7 Nadprzewodniki
- 8 Odniesienia
Fabuła
Hel został odkryty nie na Ziemi, ale na Słońcu. W rzeczywistości jego nazwa pochodzi od greckiego słowa „helios”, które oznacza słońce. Samo istnienie pierwiastka kontrastowało z układem okresowym Dymitra Mendelejewa, ponieważ nie było w nim miejsca na nowy gaz; to znaczy, do tego czasu nie podejrzewano już absolutnie nic o gazach szlachetnych.
Nazwa „hel”, zapisana w języku angielskim jako „hel”, kończyła się przyrostkiem -ium, określającym go jako metal; właśnie dlatego, że nie można dopuścić do istnienia innego gazu niż tlen, wodór, fluor, chlor i azot.
Nazwa ta została wyznaczona przez angielskiego astronoma Normana Lockyera, który badał z Anglii to, co zaobserwował francuski astronom Jules Janssen w Indiach podczas zaćmienia Słońca w 1868 roku.
Była to żółta linia widmowa nieznanego dotąd pierwiastka. Lockyer twierdził, że było to spowodowane obecnością nowego pierwiastka chemicznego znalezionego w Słońcu.
W 1895 roku, prawie dwadzieścia lat później, szkocki chemik Sir William Ramsay rozpoznał to samo widmo w pozostałościach gazu, kiedy badał radioaktywny minerał: cleveite. A więc hel był tu również na Ziemi.
Fizyczne i chemiczne właściwości
Wygląd
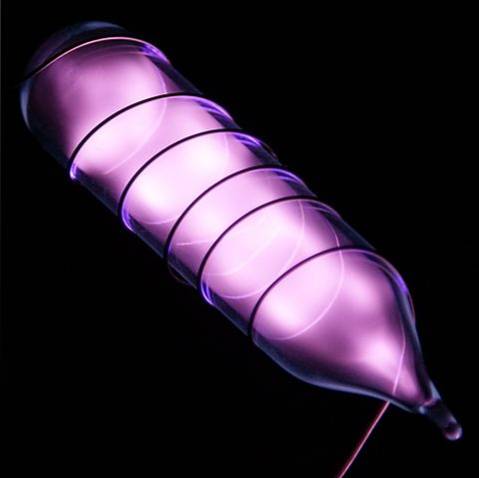
Hel to bezbarwny, bezwonny gaz, który nie ma smaku i jest obojętny. Jednak po zastosowaniu wstrząsu elektrycznego, w zależności od różnicy napięcia, zaczyna on świecić jako szaro-fioletowa mgiełka (zdjęcie powyżej), a następnie świecić pomarańczowym blaskiem. Dlatego światła helowe są pomarańczowe.
Liczba atomowa (Z)
dwa
Masa cząsteczkowa
4,002 g / mol
Temperatura topnienia
-272,2 ° C
Temperatura wrzenia
-268,92 ° C
Gęstość
-0,1786 g / l, w normalnych warunkach, czyli w fazie gazowej.
-0,145 g / ml ciekłego helu w temperaturze topnienia.
-0,125 g / ml, gdy hel zaczyna wrzeć.
-0,187 g / ml, przy 0 K i 25 atm, to znaczy hel w stanie stałym w tych określonych warunkach ciśnienia i temperatury.
Potrójny punkt
2,177 K i 5,043 kPa (0,04935 atm)
Punkt krytyczny
5,1953 K i 0,22746 MPa (2,2448 atm)
Ciepło topnienia
0,0138 kJ / mol
Ciepło parowania
0,0829 kJ / mol
Molowa pojemność cieplna
20,78 J / (mol K)
Ciśnienie pary
0,9869 atm przy 4,21 K. Ta wartość daje wyobrażenie o tym, jak ulotny może być hel i jak łatwo może się ulotnić w temperaturze pokojowej (blisko 298 K).
Energie jonizacji
-Pierwsza: 2372,3 kJ / mol (He+ gazowy)
-Po drugie: 5250,5 kJ / mol (Hedwa+ gazowy)
Energie jonizacji helu są szczególnie wysokie, ponieważ gazowy atom musi stracić elektron, który doświadcza silnego skutecznego ładunku jądrowego. Można to również zrozumieć, biorąc pod uwagę mały rozmiar atomu i to, jak „blisko” są dwa elektrony od jądra (z jego dwoma protonami i dwoma neutronami).
Rozpuszczalność
W wodzie na każde 100 ml wody o temperaturze 0 ºC rozpuszcza się 0,97 ml, co oznacza, że jest słabo rozpuszczalny.
Reaktywność
Hel jest drugim w naturze najmniej reaktywnym pierwiastkiem chemicznym. W normalnych warunkach można powiedzieć, że jest to gaz obojętny; Nigdy (wydaje się) nie można manipulować związkiem helu w pomieszczeniu lub laboratorium bez wywierania na niego ogromnego ciśnienia; a może dramatycznie wysokie lub niskie temperatury.
Przykład, który widzimy w związku NadwaOn, który jest stabilny tylko pod ciśnieniem 300 GPa, reprodukowany w diamentowej komórce kowadła.
Podczas gdy wiązania chemiczne w NadwaSą „dziwne”, ponieważ ich elektrony są dobrze ulokowane w kryształach, daleko im do prostych interakcji Van der Wallsa, a zatem nie składają się po prostu z atomów helu uwięzionych przez agregaty molekularne. Tu pojawia się dylemat między tym, które związki helu są prawdziwe, a które nie..
Na przykład cząsteczki azotu pod wysokim ciśnieniem mogą uwięzić atom helu, tworząc rodzaj klatratu, He (Ndwa)jedenaście.
Podobnie istnieją endoedryczne kompleksy kationów fulerenów, C.60+n i C70+n, w których jamach mogą pomieścić atomy helu; i molekularny kation HeH+ (He-H+), znalezione w bardzo odległych mgławicach.
Numer utleniania
Kto z ciekawości spróbuje obliczyć stopień utlenienia helu w którymkolwiek z jego związków, stwierdzi, że jest to równe 0. W NadwaMógłby na przykład pomyśleć, że jego wzór odpowiada hipotetycznym jonom Nadwa+mamdwa-; ale takie byłoby założenie, że ma on czysto jonowy charakter, podczas gdy w rzeczywistości jego wiązania są dalekie od takich.
Ponadto hel nie pozyskuje elektronów, ponieważ nie może pomieścić ich na orbicie 2s, co jest energetycznie niedostępne; Nie jest też możliwe, aby je utracił z powodu niewielkich rozmiarów atomu i wielkiego efektywnego ładunku jądrowego jądra. Dlatego hel zawsze występuje (w teorii) jako atom He0 w jej pochodnych związkach.
Struktura i konfiguracja elektroniczna
Hel, podobnie jak wszystkie gazy obserwowane w makroskali, zajmuje objętość pojemników, w których jest przechowywany, dzięki czemu ma nieokreślony kształt. Jednak gdy temperatura spada i zaczyna schładzać się poniżej -269 ºC, gaz skrapla się w bezbarwną ciecz; hel I, pierwsza z dwóch faz ciekłych dla tego pierwiastka.
Przyczyną kondensacji helu w tak niskiej temperaturze są niewielkie siły rozpraszania, które utrzymują razem jego atomy; niezależnie od rozważanej fazy. Można to wytłumaczyć na podstawie jego konfiguracji elektronicznej:
1sdwa
W którym dwa elektrony zajmują orbital atomowy 1s. Atom helu można wizualizować jako prawie doskonałą kulę, której jednorodne obwody elektroniczne są mało podatne na polaryzację przez efektywny ładunek jądrowy dwóch protonów w jądrze..
Zatem spontaniczne i indukowane momenty dipolowe są rzadkie i bardzo słabe; więc temperatura musi zbliżać się do zera absolutnego, aby atomy He zbliżały się wystarczająco wolno i osiągały, że ich siły dyspersyjne definiują ciecz; lub nawet lepiej, kryształ helu.
Dimery
W fazie gazowej przestrzeń oddzielająca atomy He jest taka, że można założyć, że są one zawsze od siebie oddzielone. Do tego stopnia, że w fiolce o małej objętości hel wydaje się bezbarwny, dopóki nie zostanie poddany wyładowaniu elektrycznemu, które jonizuje jego atomy w postaci szarej i niezbyt jasnej mgiełki..
Jednak w fazie ciekłej atomy He, nawet przy ich słabym oddziaływaniu, nie mogą być dłużej „ignorowane”. Teraz siła rozpraszania pozwala im na chwilowe połączenie się, tworząc dimery: He-He lub Hedwa. Stąd hel, o którym mogę myśleć, jak o ogromnych skupiskach Niegodwa w równowadze z jego atomami w fazie gazowej.
Dlatego tak trudno odróżnić hel I od jego oparów. Jeśli ta ciecz zostanie wylana z hermetycznego pojemnika, ucieka jako biaława flara..
Hel II
Gdy temperatura spada jeszcze bardziej, osiągając 2178 K (-270,972 ºC), następuje przemiana fazowa: hel I przekształca się w hel II.
Od tego momentu już fascynujący ciekły hel staje się nadciekłym lub kwantowym; to znaczy, że ich makroskopowe właściwości manifestują się tak, jakby dimery Hedwa były pojedynczymi atomami (i być może nimi są). Brakuje mu całkowitej lepkości, ponieważ nie ma powierzchni, która mogłaby zatrzymać atom podczas jego ślizgania się lub „wspinania”.
Dlatego hel II może wspinać się po ściankach szklanego pojemnika pokonując siłę grawitacji; bez względu na to, jak wysokie są, o ile powierzchnia pozostaje w tej samej temperaturze i dlatego nie ulatnia się.
Z tego powodu ciekły hel nie może być przechowywany w szklanych pojemnikach, ponieważ uciekałby przy najmniejszym pęknięciu lub szczelinie; bardzo podobny do tego, jak to by się stało z gazem. Zamiast tego do konstrukcji takich zbiorników (zbiorników Dewara) używana jest stal nierdzewna.
Kryształy
Nawet gdyby temperatura spadła do 0 K (zera absolutnego), siła rozpraszania między atomami He nie byłaby wystarczająco duża, aby uporządkować je w strukturę krystaliczną. Aby nastąpiło zestalenie, ciśnienie musi wzrosnąć do około 25 atm; a następnie pojawiają się zwarte sześciokątne kryształy helu (hcp).
Badania geofizyczne pokazują, że ta struktura hcp pozostaje niezmieniona niezależnie od tego, jak bardzo wzrasta ciśnienie (do rzędu gigapaskali, GPa). Jednak istnieje wąski obszar na ich wykresie ciśnienie-temperatura, w którym te kryształy hcp przechodzą przejście do fazy sześciennej centrowanej na ciele (bcc)..
Gdzie znaleźć i uzyskać
Kosmos i skały

Hel jest drugim najbardziej rozpowszechnionym pierwiastkiem we Wszechświecie, ustępując tylko wodórowi. Gwiazdy nieustannie wytwarzają niezmierzone ilości atomów helu poprzez fuzję dwóch jąder wodoru podczas procesu nukleosyntezy..
Podobnie każdy proces radioaktywny, w którym emitowane są cząsteczki α, jest źródłem produkcji atomów helu, jeśli oddziałują one z elektronami w środowisku; na przykład z ciałami skalistymi w złożach radioaktywnych minerałów uranu i toru. Te dwa pierwiastki ulegają rozpadowi radioaktywnemu, zaczynając od uranu:
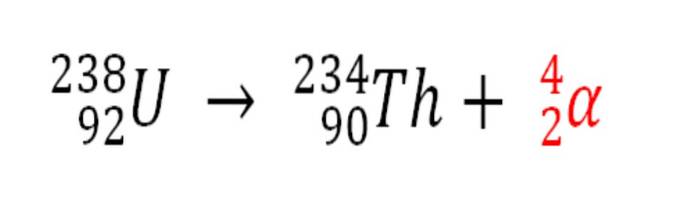
Dlatego w skałach, w których skoncentrowane są te radioaktywne minerały, zostaną uwięzione atomy helu, które zostaną uwolnione po ich strawieniu w kwaśnym środowisku..
Wśród niektórych z tych minerałów są cleveite, karnotyt i uraninit, wszystkie złożone z tlenków uranu (UOdwa lub U3LUB8) oraz tor, zanieczyszczenia metalami ciężkimi i ziemiami rzadkimi. Hel nawadniany podziemnymi kanałami może gromadzić się w zbiornikach gazu ziemnego, źródłach mineralnych lub w żelazach meteorytów.
Szacuje się, że w litosferze produkuje się hel o masie odpowiadającej 3000 ton rocznie, w wyniku radioaktywnego rozpadu uranu i toru..
Powietrze i morza
Hel nie jest dobrze rozpuszczalny w wodzie, więc raczej wcześniej niż później wypływa z głębin (gdziekolwiek jest jego pochodzenie), aż przecina warstwy atmosfery i ostatecznie dociera do przestrzeni kosmicznej. Jej atomy są tak małe i lekkie, że pole grawitacyjne Ziemi nie może ich zatrzymać w atmosferze..
W związku z powyższym stężenie helu zarówno w powietrzu (5,2 ppm), jak iw morzach (4 ppt) jest bardzo niskie..
Gdybyśmy chcieli go wydobyć z któregokolwiek z tych dwóch mediów, „najlepszą” opcją byłoby powietrze, które najpierw musiałoby zostać poddane skraplaniu w celu skroplenia wszystkich gazów składowych, podczas gdy hel pozostaje w stanie gazowym..
Jednak pozyskiwanie helu z powietrza jest niepraktyczne, ale ze skał wzbogaconych w minerały radioaktywne; lub jeszcze lepiej, ze złóż gazu ziemnego, gdzie hel może stanowić do 7% jego całkowitej masy.
Upłynnianie i destylacja gazu ziemnego
Zamiast skraplania powietrza łatwiej i bardziej opłaca się stosować gaz ziemny, którego skład helu jest niewątpliwie dużo większy. Tak więc surowcem par excellence (handlowym) do otrzymywania helu jest gaz ziemny, który można również poddać destylacji frakcyjnej..
Końcowy produkt destylacji jest wykańczany poprzez oczyszczanie węglem aktywnym, przez który przepływa bardzo czysty hel. Wreszcie hel jest oddzielany od neonu w procesie kriogenicznym, w którym używany jest ciekły hel..
Izotopy
Hel występuje głównie w przyrodzie jako izotop 4On, którego nagim jądrem jest słynna cząstka α. Ten atom 4Ma dwa neutrony i dwa protony. W mniejszych ilościach jest izotop 3On, który ma tylko jeden neutron. Pierwsza jest cięższa (ma większą masę atomową) niż druga.
Tak więc para izotopów 3Mam i 4To oni określają mierzalne właściwości i to, co rozumiemy przez hel jako pierwiastek chemiczny. Ponieważ 3Jest lżejszy, zakłada się, że jego atomy mają wyższą energię kinetyczną i dlatego potrzebują jeszcze niższej temperatury do kohezji w nadciekłym.
Plik 3Uważany jest za bardzo rzadki gatunek na Ziemi; jednak na glebach księżycowych występuje liczniej (około 2000 razy więcej). Dlatego Księżyc był tematem projektów i historii jako potencjalne źródło 3On, który mógłby zostać użyty jako paliwo jądrowe do statku kosmicznego przyszłości.
Wśród innych izotopów helu można wymienić następujące, wraz z ich okresami półtrwania: 5Mam (t1/2= 7,610−22 s), 6Mam (t1/2= 0,8 s) i 8Mam (t1/2= 0,119 s).
Ryzyka
Hel jest gazem obojętnym i dlatego nie bierze udziału w żadnej z reakcji zachodzących w naszym organizmie..
Jego atomy praktycznie wchodzą i wychodzą w wydychanym powietrzu bez ich interakcji z biomolekułami, które nie wywołują późniejszego efektu; z wyjątkiem dźwięku emitowanego przez struny głosowe, które stają się wyższe i mają wyższą częstotliwość.
Osoby, które wdychają hel z balonu (z umiarem), mówią wysokim głosem, podobnym do głosu wiewiórki (lub kaczki).
Problem polega na tym, że jeśli wdycha niewłaściwą ilość helu, ryzykuje uduszeniem, ponieważ jego atomy wypierają cząsteczki tlenu; i dlatego nie będziesz w stanie oddychać, dopóki nie wydychasz całego helu, który z kolei pod wpływem jego ciśnienia może rozerwać tkankę płuc lub spowodować uraz barotraumy.
Z powodu tego, co właśnie wyjaśniono, zgłoszono przypadki osób, które zmarły w wyniku wdychania helu.
Z drugiej strony, chociaż nie stanowi zagrożenia pożarowego ze względu na brak reaktywności z tlenem (lub inną substancją), to jeśli jest przechowywany pod wysokim ciśnieniem i ucieka, jego wyciek może być fizycznie niebezpieczny..
Aplikacje
Fizyczne i chemiczne właściwości helu sprawiają, że jest to nie tylko gaz specjalny, ale także bardzo przydatna substancja do zastosowań wymagających ekstremalnie niskich temperatur. W tej sekcji zostaną omówione niektóre z tych aplikacji lub zastosowań..
Systemy ciśnieniowe i upustowe
W niektórych systemach konieczne jest zwiększenie ciśnienia (zwiększenie ciśnienia), a do tego należy wtryskiwać lub dostarczać gaz, który nie wchodzi w interakcje z żadnym z jego składników; np. z odczynnikami lub powierzchniami wrażliwymi na niepożądane reakcje.
W ten sposób ciśnienie można zwiększać za pomocą objętości helu, którego obojętność chemiczna sprawia, że idealnie nadaje się do tego celu. Atmosfera obojętna, którą tworzy, przewyższa w niektórych przypadkach atmosferę azotu.
Do procesu odwrotnego, czyli oczyszczania, wykorzystywany jest również hel ze względu na jego zdolność do przenoszenia całego tlenu, pary wodnej lub innego gazu, którego obecność chcemy usunąć. W ten sposób ciśnienie w układzie jest redukowane po opróżnieniu helu..
Wykrywanie wycieków
Hel może przeciekać nawet przez najmniejsze pęknięcie, dlatego służy również do wykrywania wycieków w rurach, pojemnikach wysokopróżniowych lub zbiornikach kriogenicznych.
Czasami wykrywanie można przeprowadzić wizualnie lub dotykiem; jednak to głównie detektor „daje” sygnał, gdzie i ile helu ulatnia się z badanego systemu..
Gaz nośny
Atomy helu, jak wspomniano w układach przedmuchowych, mogą nosić ze sobą, w zależności od ciśnienia, cięższe cząsteczki. Na przykład zasada ta jest stosowana codziennie w analizie chromatografii gazowej, ponieważ może przeciągać rozpyloną próbkę wzdłuż kolumny, gdzie oddziałuje z fazą stacjonarną..
Balony i sterowce

Ze względu na małą gęstość w porównaniu z powietrzem i ponownie brak reaktywności z tlenem, był używany do nadmuchiwania balonów na imprezach dla dzieci (zmieszanych z tlenem, aby nikt się nie dusił) i sterowców (górne zdjęcie), bez stwarzania ryzyka pożaru.
Nurkowanie

Kiedy nurkowie schodzą na większe głębokości, mają trudności z oddychaniem z powodu dużego ciśnienia wywieranego przez wodę. Dlatego hel jest dodawany do ich zbiorników z tlenem, aby zmniejszyć gęstość gazu, który nurek oddycha i wydycha, a tym samym może być wydychany mniejszym nakładem pracy..
Spoiny łukowe
W procesie spawania łuk elektryczny zapewnia wystarczającą ilość ciepła, aby oba metale mogły się ze sobą połączyć. Jeśli zostanie to zrobione w atmosferze helu, żarzący się metal nie będzie reagował z tlenem w powietrzu, aby stać się jego odpowiednim tlenkiem; dlatego hel zapobiega temu zjawisku.
Nadprzewodniki
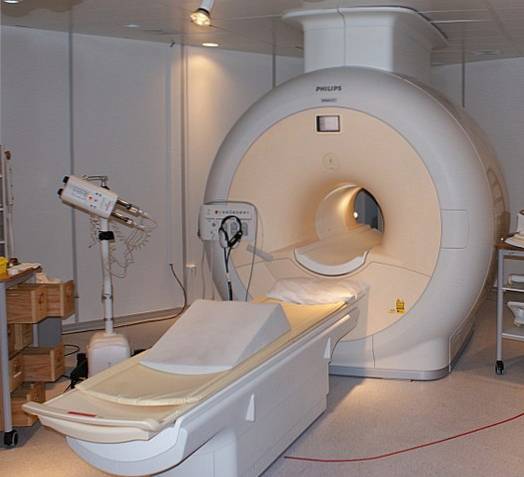
Ciekły hel jest tak zimny, że może zamrozić metale w nadprzewodniki. Dzięki temu udało się wyprodukować bardzo silne magnesy, które chłodzone ciekłym helem znalazły zastosowanie w skanerach obrazowych czy spektrometrach magnetycznego rezonansu jądrowego..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Andy Extance. (17 kwietnia 2019). Jon wodorku helu po raz pierwszy wykryty w kosmosie: dowody na nieuchwytną chemię od pierwszych minut wszechświata. Źródło: chemistryworld.com
- Peter Wothers. (19 sierpnia 2009). Hel. Chemia w swoim elemencie. Źródło: chemistryworld.com
- Wikipedia. (2019). Hel. Odzyskane z: en.wikipedia.org
- Mao, H. K., Wu, Y., Jephcoat, A. P., Hemley, R. J., Bell, P. M. i Bassett, W. A. (1988). Struktura krystaliczna i gęstość helu do 232 kbar. Odzyskany z: items.adsabs.harvard.edu
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Hel. Baza danych PubChem. CID = 23987. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Mary-Ann Muffoletto. (6 lutego 2017). W górę, w górę i daleko: chemicy mówią „tak”, hel może tworzyć związki. Uniwersytet Stanowy Utah. Odzyskany z: phys.org
- Steve Gagnon. (s.f.). Izotopy pierwiastka helu. Jefferson Lab. Pobrane z: education.jlab.org
- Advameg, Inc. (2019). Hel. Odzyskany z: chemistryexplained.com


Jeszcze bez komentarzy