
Właściwości fizyczne i chemiczne heksanu (C6H14), budowa, zastosowania, toksyczność
Plik heksan jest węglowodorem charakteryzującym się tym, że jest związkiem organicznym o skondensowanym wzorze chemicznym C6H.14. Jest to bezbarwna, przezroczysta ciecz, której nie można mieszać z wodą. Ma pięć izomerów, z których liniowy jest jednym z najważniejszych węglowodorów parafinowych w przemyśle i badaniach.
Heksan otrzymywany jest poprzez frakcjonowaną destylację ropy naftowej. Podobnie naturalnie występuje w owocach cytrusowych i lotnych frakcjach różnych roślin lub owoców, takich jak jabłko, guawa, prażone orzechy laskowe, słodkie ziemniaki i szałwia..
Jest to wysoce łatwopalna, lotna ciecz znajdująca się w benzynie, szybkoschnących klejach i cemencie gumowym. Heksan jest stosowany jako rozpuszczalnik w procesie ekstrakcji olejów roślinnych, a także lipidów i tłuszczów występujących w zanieczyszczonej wodzie i glebie.
Osoby zawodowo narażone na heksan mogą doznać uszkodzenia obwodowego układu nerwowego objawiającego się mrowieniem i skurczami nóg i rąk; oprócz uogólnionego osłabienia mięśni, aw ciężkich przypadkach zaniku mięśni szkieletowych.
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne heksanów
- 1.1 Wygląd fizyczny
- 1.2 Masa molowa
- 1.3 Zapach
- 1.4 Próg zapachu
- 1.5 Gęstość
- 1.6 Temperatura topnienia
- 1.7 Temperatura wrzenia
- 1.8 Temperatura zapłonu
- 1.9 Rozpuszczalność w wodzie
- 1.10 Rozpuszczalność w rozpuszczalnikach
- 1.11 Względna gęstość oparów z powietrzem
- 1.12 Współczynnik podziału oktanol / woda
- 1.13 Prężność par
- 1.14 Długość fali przy maksymalnej gęstości optycznej
- 1.15 Współczynnik załamania światła
- 1.16 Lepkość
- 1.17 Pojemność kaloryczna
- 1.18 Ciepło spalania
- 1.19 Ciepło parowania
- 1.20 Napięcie powierzchniowe
- 1.21 Potencjał jonizacyjny
- 1.22 Stabilność
- 1.23 Reaktywność
- 2 Struktura heksanu
- 2.1 Oddziaływania międzycząsteczkowe
- 2.2 Izomery
- 3 Zastosowania
- 4 Toksyczność
- 4.1 Wdychanie i kontakt
- 4.2 Bezpieczna dawka
- 5 Referencje
Właściwości fizyczne i chemiczne heksanów
Wygląd fizyczny
Bezbarwna, przezroczysta i bardzo lotna ciecz.
Masa cząsteczkowa
86,178 g / mol
Zapach
Podobny do benzyny
Próg zapachu
1,5 ppm
Gęstość
0,6606 g / ml
Temperatura topnienia
-96 do -94 ºC
Temperatura wrzenia
68,5 do 69,1 ° C
punkt zapłonu
-22 ºC (zamknięty tygiel).
Rozpuszczalność w wodzie
9,5 mg / L (praktycznie niemieszalny z wodą)
Rozpuszczalność w rozpuszczalnikach
Bardzo dobrze rozpuszczalny w etanolu, rozpuszczalny w eterze etylowym i chloroformie. Mieszalny z alkoholem, chloroformem i eterem.
Względna gęstość oparów z powietrzem
2,97 (powietrze = 1)
Współczynnik podziału oktanol / woda
Log P = 3764
Ciśnienie pary
17,60 kPa w 20 ° C
Długość fali o maksymalnej gęstości optycznej
200 nm
Współczynnik załamania światła
1,375
Lepkość
0,3 mPa s
Pojemność kaloryczna
265,2 JK-1Kret-1
Ciepło spalania
4163,2 kJ mol-1
Ciepło parowania
31,56 kJ mol-1
Napięcie powierzchniowe
17,89 mN / m przy 25 ° C
Potencjał jonizacyjny
10,18 eV
Stabilność
Stabilny. Niekompatybilny z utleniaczami, chlorem, fluorem, nadchloranem magnezu. Z powietrzem tworzy mieszaninę wybuchową.
Reaktywność
Heksan może gwałtownie reagować z materiałami utleniającymi, które mogą obejmować ciekły chlor, stężony tlen, podchloryn sodu i podchloryn wapnia. Jest również niezgodny z czterotlenkiem diazotu. Heksan może atakować niektóre rodzaje tworzyw sztucznych, gumę i powłoki.
Struktura heksanu
Oddziaływania międzycząsteczkowe
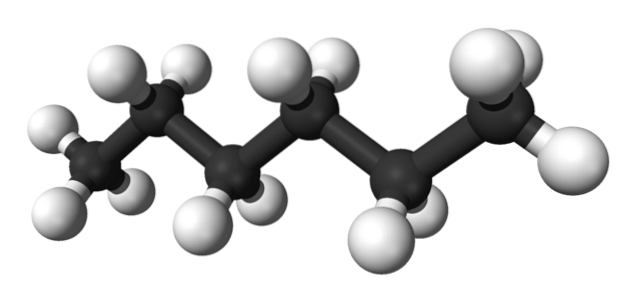
Pierwszy obraz przedstawia cząsteczkę n-heksan reprezentowany przez model kija i kulki. Czarne kule odpowiadają atomom węgla, tworzącym zygzakowaty szkielet węglowy, podczas gdy białe kule to atomy wodoru. Plik n-Dlatego heksan jest węglowodorem, liniowym i wysoce dynamicznym.
Ponieważ wszystkie jej wiązania C-H mają niską polarność, cząsteczce brakuje momentu dipolowego. W ten sposób ich interakcje międzycząsteczkowe nie są typu dipol-dipol, ale zależą wyłącznie od masy cząsteczkowej i sił dyspersyjnych Londynu..
Każda cząsteczka n-Heksan „dopasowuje się” jeden do drugiego w bardzo niskich temperaturach, jak można by założyć w jego strukturze krystalicznej. Z drugiej strony, w cieczy ich szkielety wyginają się i obracają wiązaniami C-H, powodując, że ciecz ta jest lotna i wrze w temperaturze 68,7 ° C..
Izomery
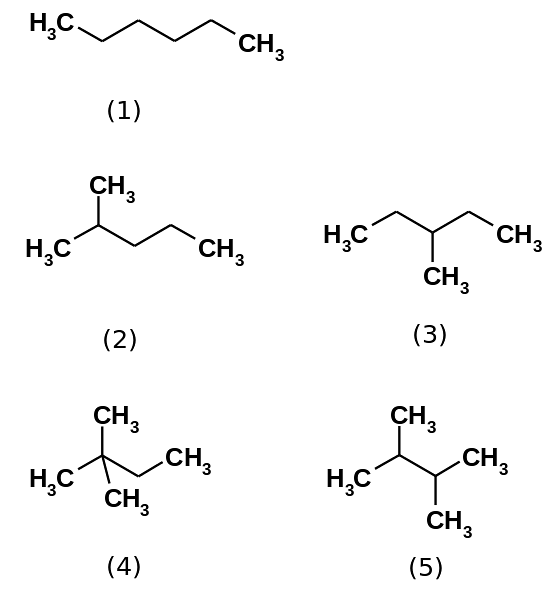
Heksan węglowodoru w rzeczywistości składa się z pięciu izomerów, będących n-heksan najmniej rozgałęziony, (1). Pozostałe cztery izomery to w kolejności rosnącej:
2-metylopropan (2)
3-metylopropan (3)
2,2-dimetylobutan (4)
2,3-dimetylobutan (5)
Zauważ również, że struktury stają się bardziej rozgałęzione od (1) do (5). Będąc bardziej rozgałęzionymi, siły dyspersyjne zmniejszają się, ponieważ nie ma już liniowych części, które skutecznie klinują się. Prowadzi to do spadku i zmienności temperatur wrzenia izomerów; chociaż obserwuje się pewne akceptowalne rozbieżności.
Zarówno 2-metylopropan (temperatura wrzenia = 60,3 ° C), jak i 3-metylopropan (temperatura wrzenia = 63,3 ° C) są jednakowo rozgałęzione, ale ich temperatury wrzenia są różne. Następnie dodaje się 2,3-dimetylobutan (peb = 58 ºC), aby ostatecznie określić 2,2-dimetylobutan jako najbardziej lotną ciecz (peb = 49,7 ºC).
Aplikacje
Heksan jest mieszany z podobnymi chemikaliami w celu wytworzenia rozpuszczalników. Wśród nazw nadanych tym rozpuszczalnikom są dostępne w handlu heksany, mieszane heksany itp. Stosowane są jako środki czyszczące w przemyśle tekstylnym, meblarskim i wklęsłodrukowym..
Heksan jest składnikiem klejów stosowanych do hydroizolacji dachów, obuwia i skóry. Służy również do oprawiania książek, do formowania pigułek i tabletek, konserw, produkcji opon i piłek do baseballu..
Heksan jest używany do określania współczynnika załamania światła minerałów i cieczy wypełniającej termometry zamiast rtęci; zwykle z czerwonym lub niebieskim odcieniem. Służy również do ekstrakcji tłuszczu i oleju z wody do analizy jej zanieczyszczeń..
Heksan jest używany jako rozpuszczalnik w ekstrakcji oleju z nasion warzyw, takich jak soja, rzepak czy jeżyna. Ponadto służy do odtłuszczania części różnego pochodzenia. Znajduje zastosowanie w denaturacji alkoholu, w metodzie analizy HPLC oraz w spektrofotometrii.
Toksyczność
Wdychanie i kontakt
Ostra toksyczność heksanu jest stosunkowo niska, chociaż jest to łagodny środek znieczulający. Ostra ekspozycja na wysokie stężenia heksanu może spowodować, poprzez wdychanie, łagodną depresję ośrodkowego układu nerwowego (OUN), objawiającą się zawrotami głowy, zawrotami głowy, łagodnymi nudnościami i bólem głowy..
Może również powodować zapalenie skóry i podrażnienie oczu i gardła. Przewlekłe wdychanie heksanu, związane z aktywnością zawodową, może powodować uszkodzenie obwodowego układu nerwowego (polineuropatia czuciowo-ruchowa).
Początkowe objawy to mrowienie i skurcze nóg i ramion, a następnie osłabienie mięśni. W ciężkich przypadkach może wystąpić zanik mięśni szkieletowych, wraz z utratą koordynacji i problemami ze wzrokiem.
Toksyczność heksanu jest związana z powstaniem metabolitu heksano-2,5-dionu. Reaguje z aminokwasem lizyną z łańcucha bocznego białka, powodując utratę funkcji białka..
Bezpieczna dawka
Agencja Ochrony Środowiska (EPA) obliczyła stężenie referencyjne (RfC) dla heksanu na poziomie 0,2 mg / m3, i dawka referencyjna (RfD) 0,06 mg / kg masy ciała / dzień.
W latach sześćdziesiątych i siedemdziesiątych grupa pracowników przemysłu obuwniczego w Japonii cierpiała na zaburzenia nerwowe. Przyczyną było to, że wdychali atmosferę heksanu 500 - 2500 ppm przez 8-14 godzin dziennie.
Pracownicy wykazali znane objawy chronicznego wdychania heksanu, odkrywając lekarzy, że nerwy kontrolujące mięśnie rąk i nóg są uszkodzone..
Bibliografia
- Danielle Reid. (2019). Heksan: struktura, formuła i właściwości. Nauka. Odzyskany z: study.com
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Heksan. Baza danych PubChem. CID = 8058. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Heksan. Odzyskane z: en.wikipedia.org
- Świat molekuł. (s.f.). Cząsteczka heksanu. Odzyskany z: worldofmolecules.com
- Książka chemiczna. (2017). Heksan. Odzyskane z: chemicalbook.com
- Wspólnota Australii. (s.f.). n-heksan: źródła emisji. Odzyskany z: npi.gov.au
- EPA. (2000). Heksan. [PDF]. Odzyskany z: epa.gov
- Agencja ds. Substancji Toksycznych i Rejestru Chorób. (1999). Oświadczenie dotyczące zdrowia publicznego dla n-heksanu. Odzyskany z: atsdr.cdc.gov



Jeszcze bez komentarzy