
Charakterystyka wodorków, nazewnictwo, zastosowania i przykłady

Plik wodniaki lub binarne kwasy to związki rozpuszczone w wodzie, które składają się z wodoru i pierwiastka niemetalicznego: halogenowodoru. Jego ogólny wzór chemiczny można wyrazić jako HX, gdzie H to atom wodoru, a X to pierwiastek niemetaliczny..
X może należeć do grupy 17, halogenów lub do pierwiastków z grupy 16 bez tlenu. W przeciwieństwie do oksokwasów, węglowodory nie mają tlenu. Ponieważ węglowodory są związkami kowalencyjnymi lub cząsteczkowymi, należy wziąć pod uwagę wiązanie H-X. Ma to ogromne znaczenie i określa właściwości każdego węglowodoru..
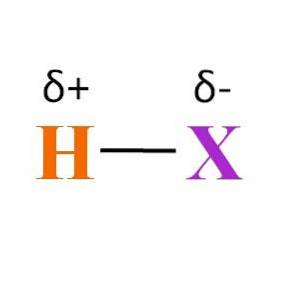
A co z wiązaniem H-X? Jak widać na powyższym obrazku, istnieje stały iloczyn momentu dipolowego różnych elektroujemności między H i X. Ponieważ X jest zwykle bardziej elektroujemny niż H, przyciąga on swoją chmurę elektronową i kończy się ujemnym ładunkiem częściowym δ-.
Z drugiej strony, oddając część swojej gęstości elektronowej X, uzyskuje dodatni ładunek częściowy δ +. Im bardziej ujemne δ-, tym bogatsze w elektrony X i większy niedobór elektronów w H. Dlatego w zależności od tego, który pierwiastek X jest, węglowodór może być mniej lub bardziej polarny.
Obraz ujawnia również strukturę wodniaków. H-X to liniowa cząsteczka, która może oddziaływać z inną na jednym ze swoich końców. Im bardziej polarny jest HX, tym silniej lub powinowactwa będą oddziaływać jego cząsteczki. W rezultacie wzrośnie jego temperatura wrzenia lub topnienia.
Jednak interakcje H-X - H-X są nadal wystarczająco słabe, aby spowodować powstanie stałego węglowodoru. Z tego powodu w warunkach ciśnienia i temperatury otoczenia są substancjami gazowymi; Z wyjątkiem HF, który wyparowuje powyżej 20ºC.
Dlaczego? Ponieważ HF jest zdolny do tworzenia silnych wiązań wodorowych. Podczas gdy inne węglowodory, których pierwiastki niemetaliczne są mniej elektroujemne, prawie nie mogą znajdować się w fazie ciekłej poniżej 0ºC. Na przykład HCl wrze w temperaturze około -85ºC.
Czy węglowodany są substancjami kwaśnymi? Odpowiedź leży w dodatnim ładunku cząstkowym δ + na atomie wodoru. Jeśli δ + jest bardzo duże lub wiązanie H-X jest bardzo słabe, to HX będzie mocnym kwasem; jak w przypadku wszystkich wodorokwasów halogenów, po rozpuszczeniu ich odpowiednich halogenków w wodzie.
Indeks artykułów
- 1 Funkcje
- 1.1 Fizyczne
- 1.2 Chemia
- 2 Nazewnictwo
- 2.1 Bezwodna postać
- 2.2 W roztworze wodnym
- 3 Jak powstają?
- 3.1 Bezpośrednie rozpuszczanie halogenków wodoru
- 3.2 Rozpuszczanie soli niemetali za pomocą kwasów
- 4 Zastosowania
- 4.1 Środki czyszczące i rozpuszczalniki
- 4.2 Katalizatory kwasowe
- 4.3 Odczynniki do syntezy związków organicznych i nieorganicznych
- 5 przykładów
- 5.1 HF, kwas fluorowodorowy
- 5,2 H2S, siarkowodór
- 5.3 HCl, kwas solny
- 5,4 HBr, kwas bromowodorowy
- 5,5 H2Te, kwas tellurowodorowy
- 6 Odnośniki
Charakterystyka
Fizyczny
-Widocznie wszystkie wodoracydy są roztworami przezroczystymi, ponieważ HX są bardzo dobrze rozpuszczalne w wodzie. Mogą mieć żółtawe odcienie w zależności od stężenia rozpuszczonego HX.
-Są palaczami, co oznacza, że wydzielają gęste, żrące i drażniące opary (niektóre nawet przyprawiają o mdłości). Dzieje się tak, ponieważ cząsteczki HX są bardzo lotne i oddziałują z parą wodną w ośrodku otaczającym roztwory. Ponadto HX w postaci bezwodnej są związkami gazowymi..
-Hydracydy są dobrymi przewodnikami elektryczności. Chociaż HX są gatunkami gazowymi w warunkach atmosferycznych, po rozpuszczeniu w wodzie uwalniają jony (H.+X-), które umożliwiają przepływ prądu elektrycznego.
-Jego temperatury wrzenia są wyższe niż w przypadku form bezwodnych. Oznacza to, że HX (ac), co oznacza węglowodór, wrze w temperaturach powyżej HX (g). Na przykład chlorowodór HCl (g) wrze w temperaturze -85 ° C, ale kwas solny, jego kwas solny, ma temperaturę około 48 ° C..
Dlaczego? Ponieważ gazowe cząsteczki HX są otoczone cząsteczkami wody. Jednocześnie mogą zachodzić dwa rodzaje interakcji: wiązania wodorowe, HX - HdwaO - HX lub solwatacja jonowa, H.3LUB+(ac) i X-(ac). Fakt ten jest bezpośrednio związany z właściwościami chemicznymi węglowodanów..
Chemiczny
Wodoracydy są bardzo kwaśnymi roztworami, więc mają kwasowe protony H.3LUB+ mogą reagować z innymi substancjami. Gdzie H3LUB+? Z atomu wodoru z dodatnim ładunkiem częściowym δ +, który dysocjuje w wodzie i zostaje kowalencyjnie włączony do cząsteczki wody:
HX (aq) + HdwaO (l) <=> X-(ac) + H3LUB+(ac)
Zauważ, że równanie odpowiada reakcji, która ustanawia równowagę. Kiedy powstanie X-(ac) + H3LUB+(ac) jest wysoce preferowany termodynamicznie, HX uwalnia swój kwasowy proton do wody; a potem ten, z H.3LUB+ jako nowy „nośnik” może reagować z innym związkiem, nawet jeśli nie jest on mocną zasadą.
Powyższe wyjaśnia kwaśne właściwości węglowodanów. Tak jest w przypadku wszystkich HX rozpuszczonych w wodzie; ale niektóre generują bardziej kwaśne roztwory niż inne. Po co to jest? Przyczyny mogą być bardzo skomplikowane. Nie wszystkie HX (ac) faworyzują równowagę przednią w prawo, to znaczy w kierunku X-(ac) + H3LUB+(ac).
Kwasowość
A wyjątek obserwuje się w kwasie fluorowodorowym, HF (aq). Fluor jest bardzo elektroujemny, dlatego skraca odległość wiązania H-X, wzmacniając je przed jego rozpadem pod działaniem wody..
Podobnie wiązanie H-F ma znacznie lepsze nakładanie się ze względu na promień atomowy. Z drugiej strony wiązania H-Cl, H-Br lub H-I są słabsze i mają tendencję do całkowitej dysocjacji w wodzie, do punktu zerwania równowagi podniesionej powyżej..
Dzieje się tak, ponieważ inne halogeny lub chalkogeny (na przykład siarka) mają większe promienie atomowe, a zatem większe orbitale. W konsekwencji wiązanie H-X przedstawia słabsze zachodzenie orbitalne, ponieważ X jest większy, co z kolei wpływa na siłę kwasu w kontakcie z wodą..
W ten sposób malejąca kolejność kwasowości wodorokwasów halogenów jest następująca: HF< HCl Jak nazywane są wodniaki? W postaci bezwodnej, HX (g), należy je wymienić zgodnie z zaleceniami dotyczącymi halogenków wodoru: dodanie przyrostka -ide na końcu ich nazw. Na przykład HI (g) składa się z halogenku (lub wodoru) utworzonego przez wodór i jod, dlatego jego nazwa brzmi: jodżubr wodór. Ponieważ niemetale są generalnie bardziej elektroujemne niż wodór, ich stopień utlenienia wynosi +1. Z drugiej strony, w NaH wodór ma stopień utlenienia -1. Jest to kolejny pośredni sposób różnicowania wodorków cząsteczkowych od halogenów lub halogenków wodoru od innych związków.. Gdy HX (g) wejdzie w kontakt z wodą, jest reprezentowany jako HX (ac), a następnie otrzymujemy węglowodór. Aby nazwać węglowodór, HX (ac), przyrostek -ide jego form bezwodnych należy zastąpić przyrostkiem -wodorotlenowym. A przede wszystkim należy je wymienić jako kwasy. Dlatego w powyższym przykładzie HI (ac) nosi nazwę: kwaśny jodhydric. Wodorowodory można wytworzyć po prostu rozpuszczając odpowiadające im halogenki wodoru w wodzie. Można to przedstawić za pomocą następującego równania chemicznego: HX (g) => HX (ac) HX (g) jest bardzo dobrze rozpuszczalny w wodzie, więc nie ma równowagi rozpuszczalności, w przeciwieństwie do jego dysocjacji jonowej w celu uwolnienia kwaśnych protonów. Istnieje jednak metoda syntetyczna, która jest preferowana, ponieważ wykorzystuje sole lub minerały jako surowiec, rozpuszczając je w niskich temperaturach za pomocą mocnych kwasów.. Jeśli sól kuchenną NaCl rozpuszcza się w stężonym kwasie siarkowym, zachodzi następująca reakcja: NaCl (s) + Hdwapołudniowy zachód4(aq) => HCl (aq) + NaHSO4(ac) Kwas siarkowy przekazuje jeden ze swoich kwaśnych protonów do anionu chlorkowego Cl-, w ten sposób przekształcając go w kwas solny. Chlorowodór, HCl (g), może ulatniać się z tej mieszaniny, ponieważ jest bardzo lotny, zwłaszcza jeśli jego stężenie w wodzie jest bardzo wysokie. Inną produkowaną solą jest kwaśny siarczan sodu NaHSO4. Innym sposobem jego produkcji jest zastąpienie kwasu siarkowego stężonym kwasem fosforowym: NaCl (s) + H3PO4(aq) => HCl (aq) + NaHdwaPO4(ac) H3PO4 reaguje w taki sam sposób jak H.dwapołudniowy zachód4, produkując kwas solny i diwodorofosforan sodu. NaCl jest źródłem anionu Cl-, tak, że do syntezy innych węglowodorów potrzebne są sole lub minerały zawierające F.-, Br-, ja-, Sdwa-, itp. Ale użycie H.dwapołudniowy zachód4 lub H.3PO4 będzie zależeć od jego siły oksydacyjnej. Hdwapołudniowy zachód4 Jest to bardzo silny środek utleniający do tego stopnia, że utlenia nawet Br- i ja- do ich form molekularnych Brdwa i jadwa; pierwsza jest czerwonawą cieczą, a druga purpurową substancją stałą. Dlatego H3PO4 stanowi preferowaną alternatywę w takich syntezach. Zasadniczo węglowodory są używane do rozpuszczania różnych rodzajów materii. Dzieje się tak, ponieważ są to mocne kwasy i mogą z umiarem czyścić każdą powierzchnię.. Jego kwaśne protony są dodawane do związków zanieczyszczeń lub brudu, dzięki czemu są rozpuszczalne w środowisku wodnym, a następnie są ciągnięte przez wodę. W zależności od natury chemicznej wspomnianej powierzchni, można zastosować jeden lub inny kwas wodorotlenowy. Na przykład kwas fluorowodorowy nie może być używany do czyszczenia szkła, ponieważ rozpuści je na miejscu. Kwas solny służy do usuwania plam z płytek basenowych. Są również zdolne do rozpuszczania skał lub próbek stałych, a następnie wykorzystywane do celów analitycznych lub produkcyjnych na małą lub dużą skalę. W chromatografii jonowymiennej do oczyszczenia kolumny z pozostałych jonów stosuje się rozcieńczony kwas solny.. Niektóre reakcje wymagają silnie kwaśnych roztworów, aby je przyspieszyć i skrócić czas ich zachodzenia. Tu właśnie pojawiają się wodoracydy. Przykładem tego jest zastosowanie kwasu jodowodorowego w syntezie lodowatego kwasu octowego. W procesach rafineryjnych przemysł naftowy potrzebuje również wodorowęglanów. Hydracidy dostarczają nie tylko kwaśnych protonów, ale także ich odpowiednich anionów. Aniony te mogą reagować ze związkiem organicznym lub nieorganicznym, tworząc określony halogenek. W ten sposób można zsyntetyzować: fluorki, chlorki, jodki, bromki, selenki, siarczki i inne związki więcej. Te halogenki mogą mieć bardzo różnorodne zastosowania. Na przykład można je wykorzystać do syntezy polimerów, takich jak teflon; lub pośredników, z których atomy halogenu zostaną włączone do struktur molekularnych niektórych leków. Załóżmy, że cząsteczka CH3CHdwaOH, etanol, reaguje z HCl, tworząc chlorek etylu: CH3CHdwaOH + HCl => CH3CHdwaCl + HdwaLUB Każda z tych reakcji kryje w sobie mechanizm i wiele aspektów, które są brane pod uwagę w syntezach organicznych.. Nie ma wielu dostępnych przykładów węglowodorów, ponieważ liczba możliwych związków jest naturalnie ograniczona. Z tego powodu niektóre dodatkowe węglowodory są wymienione poniżej wraz z ich odpowiednią nomenklaturą (skrót (ac) jest ignorowany): Binarny węglowodór, którego cząsteczki H-F tworzą silne wiązania wodorowe, do tego stopnia, że w wodzie jest słabym kwasem. W odróżnieniu od rozważanych do tej pory węglowodorów jest wieloatomowy, to znaczy ma więcej niż dwa atomy, jednak nadal jest binarny, ponieważ składa się z dwóch pierwiastków: siarki i wodoru.. Jego kanciaste cząsteczki H-S-H nie tworzą znaczących wiązań wodorowych i można je wykryć po charakterystycznym zapachu zgniłych jaj.. Jeden z najbardziej znanych kwasów w kulturze popularnej. Wchodzi nawet w skład soku żołądkowego, obecnego w żołądku i razem z enzymami trawiennymi rozkładają pokarm. Podobnie jak kwas jodowodorowy w fazie gazowej składa się z liniowych cząsteczek H-Br, które dysocjują na jony H+ (H.3LUB+) i br- kiedy wejdą do wody. Chociaż tellur ma pewien metaliczny charakter, jego wodorotlenek wydziela nieprzyjemne i silnie trujące opary, takie jak selenowodór.. Podobnie jak inne węglowodory chalkogenidów (z grupy 16 układu okresowego), w roztworze wytwarza anion Tedwa-, więc jego wartościowość wynosi -2.Nomenklatura
Forma bezwodna
W roztworze wodnym
Jak powstają?
Bezpośrednie rozpuszczanie halogenków wodoru
Rozpuszczanie soli niemetali za pomocą kwasów
Aplikacje
Środki czyszczące i rozpuszczalniki
Katalizatory kwasowe
Odczynniki do syntezy związków organicznych i nieorganicznych
Przykłady
HF, kwas fluorowodorowy
H.dwaS, siarkowodór
HCl, kwas solny
HBr, kwas bromowodorowy
H.dwaTe, kwas tellurowodorowy
Bibliografia


Jeszcze bez komentarzy