
Struktura węglowodorów cyklicznych, właściwości, przykłady

Plik węglowodory cykliczne Są to związki organiczne składające się z atomów węgla i wodoru, które łączą się, tworząc pierścienie lub struktury cykliczne. Istnieją głównie trzy typy: alicykliczne, aromatyczne i policykliczne.
Te typy węglowodorów mogą wtedy składać się z zamkniętych wersji alkanów, alkenów i alkinów; mają pierścienie z układami aromatycznymi, takimi jak benzen i jego pochodne; lub przedstawiają skomplikowane i fascynujące struktury. Spośród nich alicykliki są najprostsze i zwykle są reprezentowane za pomocą wielokątów.
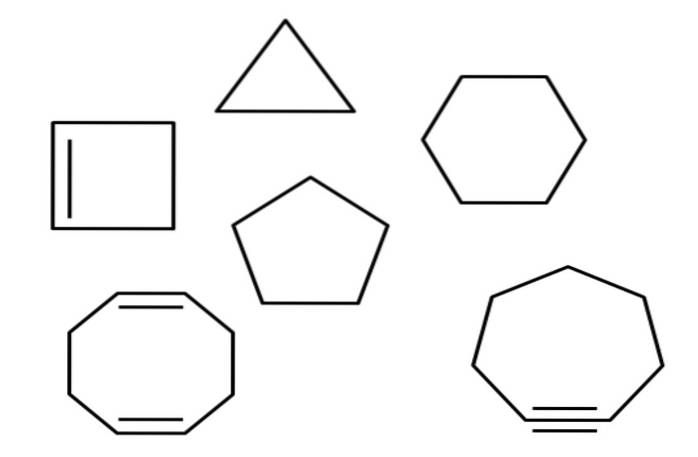
Na przykład powyżej mamy kilka alicyklicznych węglowodorów. Wyglądają jak proste wielokąty: kwadrat, trójkąt, pięciokąt, sześciokąt itp. Jeśli jedno z jego wiązań C-C można przeciąć nożyczkami, wynikiem byłby alkan, alken (jeśli ma wiązania podwójne) lub alkin (jeśli ma wiązania potrójne).
Ich właściwości nie różnią się zbytnio od węglowodorów o otwartym łańcuchu, z których pochodzą; chociaż pod względem chemicznym im są większe, tym będą stabilniejsze, a ich oddziaływanie z ośrodkiem molekularnym staje się bardziej wyraźne (ze względu na ich większą powierzchnię styku).
Indeks artykułów
- 1 Struktura
- 1.1 Zgodność
- 2 Właściwości
- 2.1 Siły międzycząsteczkowe
- 3 Nazewnictwo
- 4 Przykłady
- 5 Referencje
Struktura
Przechodząc bezpośrednio do sprawy dotyczącej ich konstrukcji, należy wyjaśnić, że nie są one płaskie, nawet jeśli w ich reprezentacji wielokątów tak się wydają. Jedynym wyjątkiem od tego stwierdzenia jest cyklopropan (trójkąt), ponieważ jego trzy punkty muszą koniecznie leżeć na tej samej płaszczyźnie..
Konieczne jest również wyjaśnienie, że terminy „cykle” i „pierścienie” są często stosowane zamiennie; pierścień nie musi być okrągły i dlatego może mieć nieskończoną geometrię, o ile jest strukturą zamkniętą. Mówi się wtedy, że cyklopropan ma trójkątny pierścień lub cykl.
Wszystkie węgle mają hybrydyzacje sp3, więc ich geometrie są czworościenne, a ich wiązania powinny być idealnie rozdzielone pod kątem 109,5 °; nie jest to jednak możliwe w przypadku struktur tak zamkniętych jak cyklopropan, cyklobutan (kwadrat) lub cyklopentan (pentagon).
Mówimy wtedy o napięciu, które destabilizuje cząsteczkę i jest określane eksperymentalnie przez pomiar średnich ciepła spalania każdej grupy CHdwa.
Konformacje
A co się dzieje, gdy występują wiązania podwójne lub potrójne? Napięcie rośnie, ponieważ tam, gdzie jest jeden z nich, konstrukcja będzie zmuszona „skurczyć się” i pozostać płaska; co kolejno wymusiłoby jedną konformację ponad innymi, prawdopodobnie przyćmiewając sąsiednie atomy wodoru.

Na powyższym obrazku pokazano dwa konformery dla cykloheksanu, aby spróbować wyjaśnić powyższe. Atomy w pozycjach do lub i mówi się, że są odpowiednio osiowe lub równikowe. Zauważ, że zamiast płaskiego sześciokąta masz krzesło (po lewej) i łódź (po prawej).
Struktury te są dynamiczne i zapewniają równowagę między nimi. Jeśli atomy w do są bardzo obszerne, pierścień „dostosuje się”, aby ustawić je w pozycjach równikowych; ponieważ tam są zorientowane w stronę boków pierścienia (co wzmocniłoby lub osłabiło interakcje międzycząsteczkowe).
Jeśli spojrzymy na każdy węgiel oddzielnie, zobaczymy, że są one tetraedryczne. Nie miałoby to miejsca, gdyby istniało podwójne wiązanie: ich hybrydyzacje spdwa zmusiłyby strukturę do spłaszczenia; a jeśli istnieje potrójne wiązanie, wyrównać. Płaska struktura benzenu jest tego maksymalnym odzwierciedleniem.
Nieruchomości
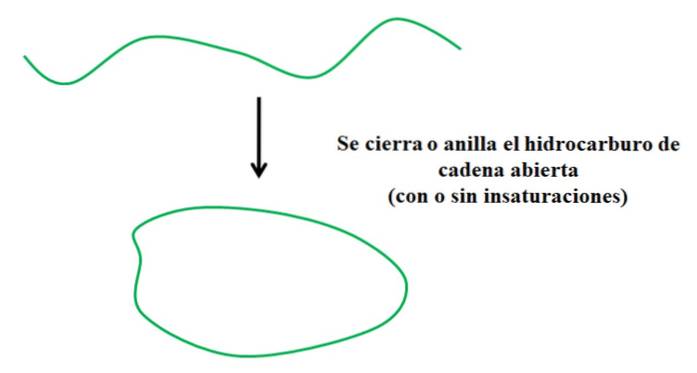
Załóżmy, że masz węglowodór o otwartym łańcuchu (z nienasyceniami lub rozgałęzieniami lub bez nich). Gdybyśmy mogli połączyć jego końce, utworzyłby pierścień lub cykl (jak na powyższym obrazku).
Z punktu widzenia syntezy organicznej nie dzieje się to tak po prostu; muszą być dobre grupy opuszczające połączone na końcach łańcucha, które przy wychodzeniu sprzyjają zamykaniu łańcucha (jeśli roztwór jest bardzo rozcieńczony).
Mając to na uwadze, można zauważyć, że zielony śladowy węglowodór podlega transformacji tylko w odniesieniu do swojej struktury; bez zrywania lub dodawania nowych wiązań z innymi atomami. Oznacza to, że chemicznie pozostaje taki sam przed i po zamknięciu lub opasaniu..
Dlatego właściwości chemiczne lub fizyczne tych alicyklicznych węglowodorów nie różnią się zbytnio od ich odpowiedników z otwartym łańcuchem. Obydwa reagują z tymi samymi gatunkami (tj. Halogenami w świetle ultrafioletowym) i mogą ulegać silnemu utlenianiu lub spalaniu poprzez wydzielanie ciepła..
Siły międzycząsteczkowe
Jest niezaprzeczalny fakt: pierścień ma większą powierzchnię styku niż łańcuch otwarty, dlatego jego interakcje międzycząsteczkowe są silniejsze.
W rezultacie ich temperatury wrzenia i topnienia są zwykle wyższe, podobnie jak ich gęstości. Tak wiele różnic można zauważyć we współczynnikach załamania światła lub prężności par.
Nomenklatura
Wracając do przykładu węglowodoru z zielonym pociągnięciem, jego nazewnictwo pozostaje niezmienione po zamknięciu się w sobie (jak wąż gryzący własny ogon). Dlatego zasady nazewnictwa pozostają takie same; chyba że odniesiono się do węglowodorów policyklicznych lub aromatycznych.
Poniżej przedstawiono trzy związki, którym nadane zostaną nazwy własne:
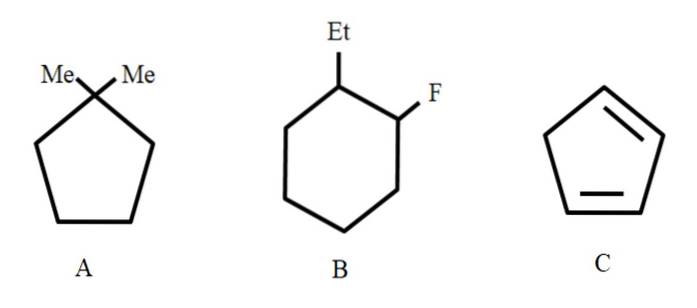
Po pierwsze, ponieważ są to struktury zamknięte, w odniesieniu do nich używany jest cykl przedrostkowy (tutaj słowo pierścień jest zdegradowane).
Od lewej do prawej mamy: cyklopentan, cykloheksan i kolejny cyklopentan. Węgle są wymienione w taki sposób, że podstawnikom przypisano najmniejsze liczby i są one również wymienione w porządku alfabetycznym..
Zatem A oznacza: 1,1-Dimetylocyklopentan. W B zaczynamy od podania podstawnika etylowego przed fluorem, więc jego nazwa brzmi: 1-etylo-2-fluorocykloheksan. A następnie dla C, podwójne wiązania są traktowane jako podstawniki, należy wskazać liczbę atomów węgla, które je tworzą: 1,3-cyklopentadien.
Przykłady
W całym artykule wspomniano o kilku cyklicznych węglowodorach. Na pierwszym zdjęciu można znaleźć: cyklopropan, cyklobutan, cyklopentan, cykloheksan, cykloheptan i cyklooktan.
Można z nich uzyskać szeroką gamę pochodnych, wystarczy umieścić na nich podwójne lub potrójne wiązania, aby mieć odpowiednio cykloalkeny lub cykloalkiny. A jeśli chodzi o węglowodory aromatyczne, wystarczy pamiętać o pierścieniu benzenowym i wymienić go lub odtworzyć w dwóch wymiarach..
Jednak najbardziej niezwykłe (i problematyczne, jeśli chodzi o zrozumienie ich nazewnictwa) są wielopierścieniowe węglowodory; to znaczy, proste wielokąty nie wystarczą nawet do ich prostego przedstawienia. Trzy z nich warte wspomnienia to: Kubańczyk, Canastano i Pagoda (zdjęcia poniżej).
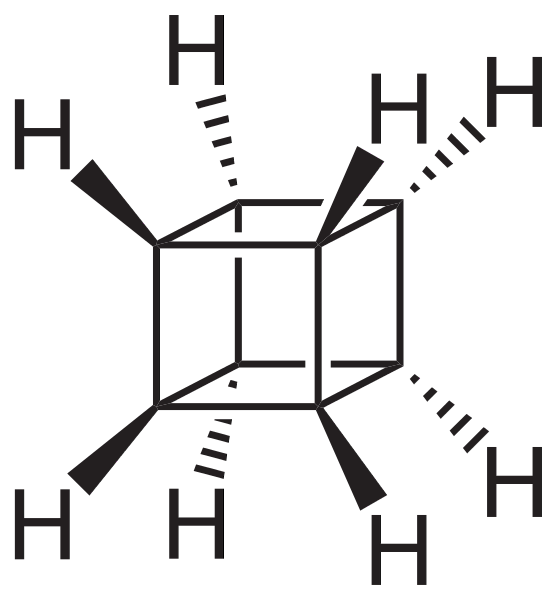
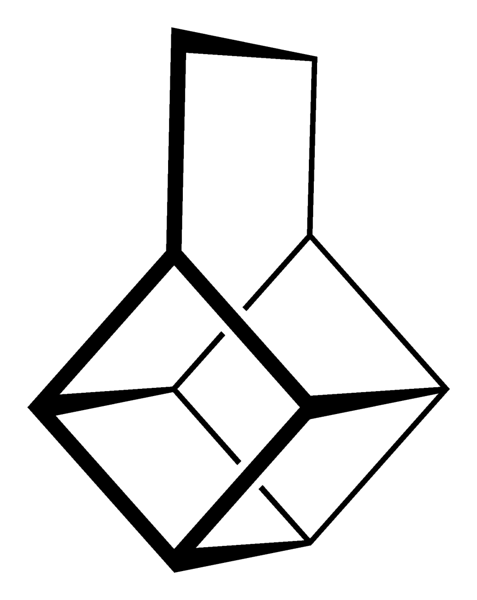

Każdy z nich ma swoją złożoną metodologię syntezy, swoją historię, sztukę i ukrytą fascynację nieskończonymi możliwościami strukturalnymi, które mogą osiągnąć proste węglowodory..
Bibliografia
- Morrison, R. T. and Boyd, R, N. (1987). Chemia organiczna. Wydanie 5. Od redakcji Addison-Wesley Interamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Reid Danielle. (2019). Węglowodory cykliczne: definicja i przykład. Nauka. Odzyskany z: study.com
- Fundacja CK-12. (05 czerwca 2019). Węglowodory cykliczne. Chemia LibreTexts. Źródło: chem.libretexts.org
- Wikipedia. (2019). Związek cykliczny. Odzyskane z: en.wikipedia.org
- Kowboj Miguel. (2019). Węglowodory cykliczne. Źródło: deciencias.net



Jeszcze bez komentarzy