
Struktura wodorku litu, właściwości, produkcja, zastosowania

Plik wodorek litu jest to krystaliczne nieorganiczne ciało stałe, którego wzór chemiczny to LiH. Jest to najlżejsza sól nieorganiczna, jej masa cząsteczkowa to zaledwie 8 g / mol. Tworzy go połączenie litowo-jonowego Li+ i jon wodorkowy H-. Oba są połączone wiązaniem jonowym.
LiH ma wysoką temperaturę topnienia. Łatwo reaguje z wodą, w wyniku czego powstaje gazowy wodór. Można go otrzymać w wyniku reakcji pomiędzy stopionym litem metalicznym i wodorem. Jest szeroko stosowany w reakcjach chemicznych do otrzymywania innych wodorków.
LiH został użyty do ochrony przed niebezpiecznym promieniowaniem, takim jak te występujące w reaktorach jądrowych, czyli promieniowaniem ALPHA, BETA, GAMMA, protonami, promieniami rentgenowskimi i neutronami..
Zaproponowano również ochronę materiałów w rakietach kosmicznych napędzanych termicznym napędem jądrowym. Prowadzone są nawet badania mające na celu ochronę człowieka przed promieniowaniem kosmicznym podczas przyszłych wypraw na planetę Mars..
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Temperatura wrzenia
- 3.5 Temperatura samozapłonu
- 3.6 Gęstość
- 3.7 Rozpuszczalność
- 3.8 Inne właściwości
- 4 Otrzymywanie
- 5 Stosować jako tarczę ochronną przed niebezpiecznym promieniowaniem
- 5.1 - W reaktorach jądrowych
- 5.2 - W kosmicznych systemach jądrowego napędu termicznego
- 5.3 - W ochronie przed promieniowaniem kosmicznym
- 6 Stosowanie jako sposób bezpiecznego przechowywania i transportu wodoru
- 7 Zastosowanie w reakcjach chemicznych
- 8 Odniesienia
Struktura
Wodór w wodorku litu ma ładunek ujemny H.-, ponieważ odejmuje elektron od metalu, który ma postać jonu Li+.
Konfiguracja elektronowa kationu Li+ to: [On] 1sdwa który jest bardzo stabilny. I elektronowa struktura anionu wodorkowego H.- wynosi: 1sdwa, który jest również bardzo stabilny.
Kation i anion są połączone siłami elektrostatycznymi.
Kryształ wodorku litu ma taką samą strukturę jak chlorek sodu NaCl, czyli sześcienną strukturę kryształu.
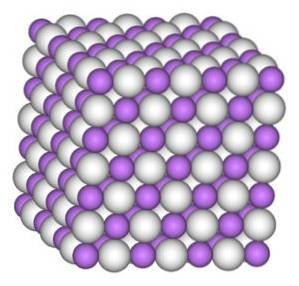
Nomenklatura
- Wodorek litu
- LiH
Nieruchomości
Stan fizyczny
Białe lub bezbarwne krystaliczne ciało stałe. Handlowy LiH może być niebiesko-szary z powodu obecności niewielkich ilości metalicznego litu..
Waga molekularna
8 g / mol
Temperatura topnienia
688 ºC
Temperatura wrzenia
Rozkłada się w temperaturze 850 ºC.
Temperatura samozapłonu
200 ºC
Gęstość
0,78 g / cm3
Rozpuszczalność
Reaguje z wodą. Jest nierozpuszczalny w eterach i węglowodorach.
Inne właściwości
Wodorek litu jest dużo bardziej stabilny niż wodorków innych metali alkalicznych i może być topiony bez rozkładu..
Tlen nie ma na nie wpływu, jeśli zostanie podgrzany do temperatury poniżej czerwieni. Nie ma na nią również wpływu chlor Cldwa i kwas solny HCl.
Kontakt LiH z ciepłem i wilgocią powoduje reakcję egzotermiczną (generuje ciepło) i wydzielanie wodoru H.dwa i wodorotlenek litu LiOH.
Może tworzyć drobny pył, który może eksplodować w kontakcie z płomieniami, ciepłem lub materiałami utleniającymi. Nie może wchodzić w kontakt z podtlenkiem azotu lub ciekłym tlenem, ponieważ może wybuchnąć lub zapalić się.
Ciemnieje pod wpływem światła.
Otrzymywanie
Wodorek litu został uzyskany w laboratorium w wyniku reakcji stopionego litu metalicznego i wodoru w temperaturze 973 K (700 ºC).
2 Li + Hdwa → 2 LiH
Dobre wyniki uzyskuje się, gdy odsłonięta powierzchnia stopionego litu jest zwiększona i gdy czas sedymentacji LiH jest zmniejszony. Jest to reakcja egzotermiczna.
Stosować jako tarczę ochronną przed niebezpiecznym promieniowaniem
LiH ma szereg cech, które sprawiają, że jest atrakcyjny do stosowania jako ochrona ludzi w reaktorach jądrowych i systemach kosmicznych. Oto niektóre z tych cech:
- Ma wysoką zawartość wodoru (12,68% masy H) i dużą liczbę atomów wodoru na jednostkę objętości (5,85 x 1022 Atomy H / cm3).
- Jego wysoka temperatura topnienia pozwala na stosowanie go w środowiskach o wysokiej temperaturze bez topnienia.
- Ma niskie ciśnienie dysocjacji (~ 20 torr w temperaturze topnienia), co pozwala na stopienie i zamrożenie materiału bez degradacji pod niskim ciśnieniem wodoru..
- Ma niską gęstość, co czyni go atrakcyjnym do stosowania w systemach kosmicznych..
- Jednak jego wadą jest niska przewodność cieplna i słabe właściwości mechaniczne. Ale to nie zmniejszyło jego przydatności.
- Części LiH, które służą jako osłony, są wytwarzane przez prasowanie na gorąco lub na zimno oraz przez stapianie i wlewanie do form. Chociaż ta ostatnia forma jest preferowana.
- W temperaturze pokojowej części są chronione przed wodą i parą wodną, a przy wysokich temperaturach przez niewielkie nadciśnienie wodoru w szczelnym pojemniku.
- W reaktorach jądrowych
W reaktorach jądrowych istnieją dwa rodzaje promieniowania:
Bezpośrednie promieniowanie jonizujące
Są to wysokoenergetyczne cząstki, które przenoszą ładunek elektryczny, takie jak cząstki alfa (α) i beta (β) oraz protony. Ten rodzaj promieniowania oddziałuje bardzo silnie z materiałami osłon, powodując jonizację poprzez oddziaływanie z elektronami atomów materiałów, przez które przechodzą..
Pośrednie promieniowanie jonizujące
Są to neutrony, promienie gamma (γ) i rentgenowskie, które wnikają i wymagają masowej ochrony, ponieważ wiążą się z emisją wtórnych naładowanych cząstek, które powodują jonizację..

Według niektórych źródeł LiH skutecznie chroni materiały i ludzi przed tego typu promieniowaniem.
- W kosmicznych układach jądrowego napędu termicznego
LiH został niedawno wybrany jako potencjalny moderator i materiał chroniący przed promieniowaniem jądrowym w jądrowych termicznych systemach napędowych statków kosmicznych o bardzo długich podróżach..

Jego niska gęstość i wysoka zawartość wodoru umożliwia efektywne zmniejszenie masy i objętości reaktora o napędzie atomowym..
- W ochronie przed promieniowaniem kosmicznym
Narażenie na promieniowanie kosmiczne jest najważniejszym zagrożeniem dla zdrowia ludzkiego w przyszłych międzyplanetarnych misjach eksploracyjnych.
W kosmosie astronauci będą wystawieni na działanie pełnego spektrum galaktycznych promieni kosmicznych (jonów o wysokiej energii) i wyrzutów cząstek Słońca (protony)..
Niebezpieczeństwo narażenia na promieniowanie potęguje długość misji. Ponadto należy również wziąć pod uwagę ochronę miejsc, w których będą przebywać odkrywcy.

W tym duchu badanie przeprowadzone w 2018 roku wykazało, że spośród badanych materiałów LiH zapewnia największą redukcję promieniowania na gram na cmdwa, tym samym będąc jednym z najlepszych kandydatów do wykorzystania w ochronie przed promieniowaniem kosmicznym. Jednak badania te wymagają pogłębienia.
Stosować jako bezpieczny środek do przechowywania i transportu wodoru
Pozyskiwanie energii z H.dwa Jest to coś, co jest badane od kilkudziesięciu lat i już znalazło zastosowanie do zastąpienia paliw kopalnych w pojazdach transportowych.
Hdwa może być stosowany w ogniwach paliwowych i przyczyniać się do zmniejszenia produkcji COdwa i niex, unikając w ten sposób efektu cieplarnianego i zanieczyszczenia. Jednak nie znaleziono jeszcze skutecznego systemu przechowywania i transportu H.dwa bezpieczny, lekki, kompaktowy lub mały, szybki do przechowywania i zwalniania H.dwa równie szybko.
Wodorek litu LiH jest jednym z wodorków alkalicznych, który ma największą zdolność magazynowania Hdwa (12,7% wagowych H). Wydanie H.dwa przez hydrolizę zgodnie z następującą reakcją:
LiH + HdwaO → LiOH + Hdwa
LiH dostarcza 0,254 kg wodoru na każdy kg LiH. Ponadto ma dużą pojemność na jednostkę objętości, co oznacza, że jest lekki i jest kompaktowym nośnikiem do przechowywania Hdwa.

Ponadto LiH tworzy się łatwiej niż inne wodorki metali alkalicznych i jest stabilny chemicznie w temperaturach i ciśnieniach otoczenia. LiH można transportować od producenta lub dostawcy do użytkownika. Następnie w wyniku hydrolizy LiH generowany jest H.dwa i to jest bezpiecznie używane.
Utworzony wodorotlenek litu LiOH można zwrócić dostawcy, który regeneruje lit przez elektrolizę, a następnie ponownie wytwarza LiH..
Z powodzeniem zbadano również, czy LiH może być stosowany w połączeniu z borowaną hydrazyną w tym samym celu..
Zastosowanie w reakcjach chemicznych
LiH umożliwia syntezę złożonych wodorków.
Jest on używany na przykład do wytwarzania trietyloborowodorku litu, który jest silnym nukleofilem w reakcjach zastępowania halogenków organicznych..
Bibliografia
- Sato, Y. and Takeda, O. (2013). System magazynowania i transportu wodoru za pomocą wodorku litu z wykorzystaniem technologii stopionej soli. W chemii stopionych soli. Rozdział 22, strony 451-470. Odzyskany z sciencedirect.com.
- NAS. National Library of Medicine. (2019). Wodorek litu. Odzyskany z: pubchem.ncbi.nlm.nih.gov.
- Wang, L. i in. (2019). Badanie wpływu termicznego wpływu wodorku litu na reaktywność reaktora ze złożem cząstek napędu jądrowego. Annals of Nuclear Energy 128 (2019) 24-32. Odzyskany z sciencedirect.com.
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Giraudo, M. i in. (2018). Akceleratorowe testy skuteczności ekranowania różnych materiałów i warstw wielowarstwowych przy użyciu wysokoenergetycznych lekkich i ciężkich jonów. Badania nad promieniowaniem 190; 526-537 (2018). Odzyskany z ncbi.nlm.nih.gov.
- Welch, F.H. (1974). Wodorek litu: materiał ekranujący wiek kosmiczny. Nuclear Engineering and Design 26, 3, luty 1974, strony 444-460. Odzyskany z sciencedirect.com.
- Simnad, M.T. (2001). Reaktory jądrowe: materiały ekranujące. W Encyklopedii materiałów: nauki i technologii (drugie wydanie). Strony 6377-6384. Odzyskany z sciencedirect.com.
- Hügle, T. i in. (2009). Hydrazyna Boran: Obiecujący materiał do przechowywania wodoru. J. Am. Chem. Soc. 2009, 131, 7444-7446. Odzyskany z pubs.acs.org.



Jeszcze bez komentarzy