
Struktura wodorotlenku glinu, właściwości, zastosowania, zagrożenia
Plik wodorotlenek glinu jest związkiem nieorganicznym, którego wzór chemiczny to Al (OH)3. W przeciwieństwie do innych wodorotlenków metali, jest to wodorotlenek amfoteryczny, zdolny do reagowania lub zachowywania się jak kwas lub zasada, w zależności od medium. Jest to biała substancja stała, dość nierozpuszczalna w wodzie, dlatego znajduje zastosowanie jako składnik środków zobojętniających kwas.
Jak Mg (OH)dwa lub brucyt, z którym ma pewne cechy chemiczne i fizyczne, w czystej postaci wygląda jak matowe, bezpostaciowe ciało stałe; ale kiedy krystalizuje z pewnymi nieczystościami, przybiera formy krystaliczne, jakby były perłami. Wśród tych minerałów naturalne źródła Al (OH)3, znaleziono gibbsyt.

Oprócz gibsytów istnieją również minerały: bajeryt, nordstrandyt i doleyit, tworzące cztery polimorfy wodorotlenku glinu. Strukturalnie są do siebie bardzo podobne, niewiele różniąc się sposobem ułożenia lub połączenia warstw lub arkuszy jonów, a także rodzajem zawartych w nich zanieczyszczeń.
Kontrolując pH i parametry syntezy, można otrzymać dowolny z tych polimorfów. Ponadto niektóre interesujące gatunki chemiczne mogą być wstawiane między warstwami, dzięki czemu powstają materiały lub związki interkalacyjne. Oznacza to zastosowanie bardziej technologicznego podejścia do Al (OH)3. Jego inne zastosowania to środki zobojętniające sok żołądkowy.
Z drugiej strony jest używany jako surowiec do otrzymywania tlenku glinu, a jego nanocząstki zostały wykorzystane jako nośnik katalityczny..
Indeks artykułów
- 1 Struktura
- 1.1 Wzór i ośmiościan
- 1.2 Polimorfy
- 2 Właściwości
- 2.1 Wygląd fizyczny
- 2.2 Masa molowa
- 2.3 Gęstość
- 2.4 Temperatura topnienia
- 2.5 Rozpuszczalność w wodzie
- 2.6 Iloczyn rozpuszczalności
- 2.7 Amfoterycyzm
- 3 Nazewnictwo
- 4 Zastosowania
- 4.1 Surowiec
- 4.2 Podpory katalityczne
- 4.3 Związki interkalacyjne
- 4.4 Ognioodporny
- 4.5 Leczniczy
- 4.6 Adsorbent
- 5 Ryzyka
- 6 Odnośniki
Struktura
Wzór i ośmiościan
Wzór chemiczny Al (OH)3 wskazuje od razu, że zależność Al3+: OH- wynosi 1: 3; to znaczy istnieją trzy aniony OH- dla każdego kationu Al3+, co jest tym samym, co powiedzenie, że jedna trzecia jego jonów odpowiada glinowi. Tym samym Al3+ i OH- oddziałują elektrostatycznie, dopóki ich odpychanie-przyciąganie utworzy sześciokątny kryształ.
Jednak Al3+ niekoniecznie otoczony trzema OH- ale sześć; dlatego mówimy o ośmiościanie koordynacyjnym, Al (OH)6, w którym występuje sześć interakcji Al-O. Każdy ośmiościan reprezentuje jednostkę, z której zbudowany jest kryształ, a wiele z nich przyjmuje struktury trójskośne lub jednoskośne.
Dolny obraz częściowo przedstawia ośmiościany Al (OH)6, ponieważ tylko cztery interakcje obserwuje się dla Al3+ (jasnobrązowe kule).
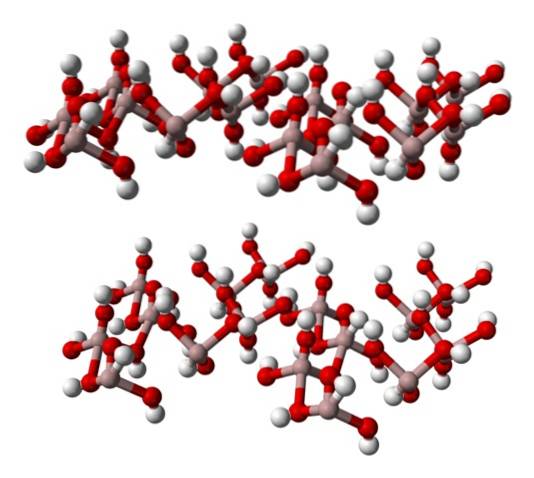
Jeśli uważnie obserwuje się tę strukturę, która odpowiada strukturze mineralnego gibsytu, można zauważyć, że białe kulki tworzą „czoła” lub powierzchnie warstw jonowych; są to atomy wodoru jonów OH-.
Zauważ również, że istnieje warstwa A i druga B (przestrzennie nie są identyczne), połączone ze sobą wiązaniami wodorowymi..
Polimorfy
Warstwy A i B nie zawsze są sprzężone w ten sam sposób, tak jak może zmieniać się ich fizyczne środowisko lub jony (sole) gospodarza. W konsekwencji kryształy Al (OH)3 różnią się w czterech formach mineralogicznych lub, w tym przypadku, polimorficznych.
Mówi się, że wodorotlenek glinu ma do czterech polimorfów: gibsyt lub hydrargilit (jednoskośny), bajeryt (jednoskośny), doyleit (trójskośny) i nordstrandyt (trójskośny). Spośród tych polimorfów gibbsyt jest najbardziej stabilny i rozpowszechniony; inne są klasyfikowane jako rzadkie minerały.
Gdyby obserwować kryształy pod mikroskopem, można by zauważyć, że ich geometria jest heksagonalna (choć nieco nieregularna). Wartość pH odgrywa ważną rolę we wzroście takich kryształów i wynikającej z nich strukturze; to znaczy, przy danym pH, może powstać polimorf lub inny.
Na przykład, jeśli ośrodek, w którym wytrąca się Al (OH)3 ma pH niższe niż 5,8, tworzy się gibsyt; podczas gdy jeśli pH jest wyższe niż ta wartość, tworzy się bajeryt.
W bardziej podstawowych mediach zwykle tworzą się kryształy nordstrandytu i doyleitu. Tak więc, będąc najbardziej rozpowszechnionym gibsytem, jest faktem, który odzwierciedla kwasowość jego zwietrzałego środowiska..
Nieruchomości
Wygląd fizyczny
Białe ciało stałe, które może występować w różnych formatach: w postaci granulatu lub proszku, o wyglądzie bezpostaciowym.
Masa cząsteczkowa
78,00 g / mol
Gęstość
2,42 g / ml
Temperatura topnienia
300 ° C Nie ma temperatury wrzenia, ponieważ wodorotlenek traci wodę, aby przekształcić się w tlenek glinu lub tlenek glinu, AldwaLUB3.
Rozpuszczalność w wodzie
1 10-4 g / 100 ml. Jednak jego rozpuszczalność wzrasta wraz z dodatkiem kwasów (H.3LUB+) lub zasady (OH-).
Iloczyn rozpuszczalności
K.sp = 3 10−34
Ta bardzo mała wartość oznacza, że tylko niewielka część rozpuszcza się w wodzie:
Al (OH)3(s) <=> Do3+(aq) + 3OH-(ac)
W rzeczywistości ta znikoma rozpuszczalność sprawia, że jest to dobry środek neutralizujący kwasowość, ponieważ nie bazuje zbytnio środowiska żołądka, ponieważ nie uwalnia prawie jonów OH.-.
Amfoterycyzm
El Al (OH)3 charakteryzuje się amfoterycznym charakterem; to znaczy, może reagować lub zachowywać się tak, jakby był kwasem lub zasadą.
Na przykład reaguje z jonami H.3LUB+ (jeśli ośrodek jest wodny) w celu utworzenia kompleksu wodnego [Al (OHdwa)6]3+; który z kolei jest hydrolizowany w celu zakwaszenia środowiska, dlatego Al3+ jon kwaśny:
Al (OH)3(s) + 3H3LUB+(ac) => [Al (OHdwa)6]3+(ac)
[Al (OHdwa)6]3+(ac) + HdwaO (l) <=> [Al (OHdwa)5(O)]dwa+(ac) + H3LUB+(ac)
Kiedy tak się dzieje, mówi się, że Al (OH)3 zachowuje się jak baza, ponieważ reaguje z H.3LUB+. Z drugiej strony może reagować z OH-, zachowując się jak kwas:
Al (OH)3(s) + OH-(ac) => Al (OH)4-(ac)
W tej reakcji biały osad Al (OH)3 rozpuszcza się w nadmiarze jonów OH-; fakt, że nie dzieje się tak samo z innymi wodorotlenkami, takimi jak magnez, Mg (OH)dwa.
El Al (OH)4-, jon glinianowy można lepiej wyrazić jako: [Al (OHdwa)dwa(O)4]-, podkreślenie liczby koordynacyjnej 6 dla kationu Al3+ (ośmiościan).
Ten jon może nadal reagować z większą ilością OH- do skompletowania ośmiościanu koordynacyjnego: [Al (OH)6]3-, zwany jonem heksahydroksoglinianowym.
Nomenklatura
Nazwa „wodorotlenek glinu”, w odniesieniu do której więcej odniesiono się do tego związku, odpowiada nazwie określanej w nomenklaturze zapasów. Na końcu pomija się (III), ponieważ stopień utlenienia aluminium wynosi +3 we wszystkich jego związkach.
Pozostałe dwie możliwe nazwy odnoszące się do Al (OH)3 Są to: trójwodorotlenek glinu, zgodnie z systematyczną nomenklaturą i zastosowaniem greckich przedrostków licznika; i wodorotlenek glinu, kończący się przyrostkiem -ico dla jednego stopnia utlenienia.
Chociaż w dziedzinie chemii nazewnictwo Al (OH)3 nie stanowi żadnego wyzwania ani zamieszania, poza nim bywa pomieszany z niejasnościami.
Na przykład gibsyt mineralny jest jednym z naturalnych polimorfów Al (OH)3, które nazywają również γ-Al (OH)3 lub α-Al (OH)3. Jednak α-Al (OH)3 może również odpowiadać minerałowi Bayerite lub β-Al (OH)3, zgodnie z nomenklaturą krystalograficzną. Tymczasem polimorfy nordstrandyt i doyleit są zwykle określane po prostu jako Al (OH)3.
Poniższa lista jasno podsumowuje to, co właśnie zostało wyjaśnione:
-Gibsyt: (γ lub α) -Al (OH)3
-Bayerit: (α lub β) -Al (OH)3
-Nordstrandite: Al (OH)3
-Doyleite: Al (OH)3
Aplikacje
Surowiec
Wodorotlenek glinu jest bezpośrednio stosowany jako surowiec do produkcji tlenku glinu lub innych nieorganicznych lub organicznych związków glinu; na przykład: AlCl3, Nie3)3, AlF3 lub NaAl (OH)4.
Podpory katalityczne
Nanocząsteczki Al (OH)3 mogą działać jako nośniki katalityczne; to znaczy, że katalizator łączy je, aby pozostać nieruchomymi na ich powierzchni, gdzie reakcje chemiczne ulegają przyspieszeniu.
Związki interkalacyjne
W części dotyczącej struktur wyjaśniono, że Al (OH)3 Składa się z warstw lub arkuszy A i B, połączonych w celu zdefiniowania kryształu. Wewnątrz znajdują się małe ośmiościenne przestrzenie lub dziury, które mogą być zajęte przez inne jony, cząsteczki metaliczne, organiczne lub obojętne..
Kiedy syntetyzowane są kryształy Al (OH)3 Mówi się, że przy tych modyfikacjach strukturalnych przygotowywany jest związek interkalacyjny; to znaczy wstawiają lub wstawiają związki chemiczne między arkuszami A i B. W ten sposób pojawiają się nowe materiały wykonane z tego wodorotlenku.
Ognioodporny
El Al (OH)3 jest dobrym środkiem zmniejszającym palność, który znajduje zastosowanie jako materiał wypełniający w wielu matrycach polimerowych. Dzieje się tak, ponieważ pochłania ciepło, aby uwolnić parę wodną, tak jak robi to Mg (OH).dwa lub brucita.
Leczniczy
El Al (OH)3 Jest również neutralizatorem kwasowości, reagując z HCl w wydzielinie żołądkowej; ponownie, podobnie jak Mg (OH)dwa mleko magnezji.
W rzeczywistości oba wodorotlenki można mieszać w różnych środkach zobojętniających sok żołądkowy, stosowanych w celu złagodzenia objawów u osób cierpiących na zapalenie żołądka lub wrzody żołądka..
Adsorbent
Po podgrzaniu poniżej temperatury topnienia wodorotlenek glinu przekształca się w aktywowany tlenek glinu (a także węgiel aktywny). To ciało stałe jest używane jako adsorbent dla niepożądanych cząsteczek, czy to barwników, zanieczyszczeń, czy zanieczyszczających gazów..
Ryzyka
Zagrożenia, jakie może stwarzać wodorotlenek glinu, nie wynikają z tego, że jest on substancją stałą, ale jako lekarstwo. Nie wymaga żadnych protokołów ani przepisów, aby go przechowywać, ponieważ nie reaguje energicznie z utleniaczami i nie jest łatwopalny..
Po spożyciu w środkach zobojętniających sok żołądkowy dostępnych w aptekach mogą wystąpić niepożądane skutki uboczne, takie jak zaparcia i zahamowanie fosforanów w jelitach. Podobnie, chociaż nie ma badań, które by to udowodniły, wiązano ją z zaburzeniami neurologicznymi, takimi jak choroba Alzheimera.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Wodorotlenek glinu. Odzyskane z: en.wikipedia.org
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Wodorotlenek glinu. Baza danych PubChem. CID = 10176082. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Danielle Reid. (2019). Wodorotlenek glinu: formuła i skutki uboczne. Nauka. Odzyskany z: study.com
- Robert Schoen i Charles E. Roberson. (1970). Struktury wodorotlenku glinu i implikacje geochemiczne. The American Mineralogist, tom 55.
- Witalij P. Isupov i kol. (2000). Synteza, struktura, właściwości i zastosowanie związków interkalacyjnych wodorotlenku glinu. Chemia na rzecz zrównoważonego rozwoju 8,121-127.
- Leki. (24 marca 2019). Efekty uboczne wodorotlenku glinu. Odzyskany z: drugs.com


Jeszcze bez komentarzy