
Struktura wodorotlenku magnezu, właściwości, nazewnictwo, zastosowania
Plik wodorotlenek magnezu jest związkiem nieorganicznym, którego wzór chemiczny to Mg (OH)dwa. W czystej postaci jest matową białą substancją stałą o amorficznym wyglądzie; Jednak przy niewielkiej i dokładnej zawartości zanieczyszczeń przekształca się w krystaliczny stały brukcyt, minerał występujący w niektórych osadach w przyrodzie i będący bogatym źródłem magnezu..
Jest słabym elektrolitem lub zasadą, więc jego dysocjacja w wodzie jest niska. Ta właściwość sprawia, że Mg (OH)dwa dobry neutralizator kwasowości do spożycia przez ludzi; lekarstwo popularnie zwane zawiesiną mleka magnezji. Jest również środkiem zmniejszającym palność, uwalniając wodę podczas rozkładu termicznego..

Na górnym obrazku przedstawiono niektóre stałe wodorotlenki magnezu, na których można dostrzec jego nieprzezroczysty biały kolor. Im bardziej są krystaliczne, tym ich powierzchnia jest szklista i perłowa.
Jego struktura krystaliczna jest osobliwa, ponieważ tworzy dwuwarstwowe sześciokątne kryształy, które są obiecującymi projektami do projektowania nowych materiałów. W tych warstwach ich dodatnie ładunki odgrywają ważną rolę ze względu na substytucję Mgdwa+ przez trójwartościowe kationy i gatunki zamknięte między ścianami złożone z anionów OH-.
Z drugiej strony, inne zastosowania wynikają w zależności od morfologii przygotowanych cząstek lub nanocząstek; jako katalizatory lub adsorbenty. We wszystkich z nich stosunek jonów Mg 1: 2 jest utrzymywany na stałym poziomie.dwa+: OH-, odzwierciedlone w tym samym wzorze Mg (OH)dwa.
Indeks artykułów
- 1 Struktura
- 1.1 Wzór i ośmiościan
- 1.2 Podwójna warstwa
- 1.3 Morfologie
- 2 Właściwości
- 2.1 Wygląd fizyczny
- 2.2 Masa molowa
- 2.3 Gęstość
- 2.4 Temperatura topnienia
- 2.5 Rozpuszczalność w wodzie
- 2.6 Współczynnik załamania światła
- 2,7 pH
- 2.8 Pojemność cieplna
- 3 Gdzie się znajduje?
- 4 Nazewnictwo
- 5 zastosowań
- 5.1 Neutralizator
- 5.2 Środki zobojętniające kwas
- 5.3 Ognioodporne
- 5.4 Catalyst
- 5.5 Adsorbent
- 6 Odnośniki
Struktura
Wzór i ośmiościan
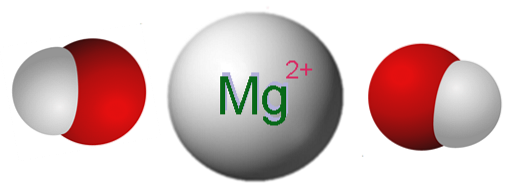
Powyższy obrazek przedstawia jony tworzące Mg (OH)dwa. Jak widać, istnieją dwa aniony OH- dla każdego kationu Mgdwa+, które oddziałują elektrostatycznie, tworząc kryształ o strukturze heksagonalnej. Ten sam wzór wskazuje, że stosunek Mg: OH wynosi 1: 2.
Jednak prawdziwa struktura kryształu jest nieco bardziej skomplikowana niż przy założeniu prostych jonów Mg.dwa+ i OH-. W rzeczywistości magnez charakteryzuje się liczbą koordynacyjną 6, więc może wchodzić w interakcje nawet z sześcioma OH-.
W ten sposób powstaje ośmiościan Mg (OH)6, gdzie atomy tlenu najwyraźniej pochodzą z OH-; a struktura kryształu opiera się teraz na rozważeniu takich ośmiościanów i ich wzajemnych interakcji.
W rzeczywistości jednostki Mg (OH)6 w końcu definiujemy dwuwarstwowe struktury, które z kolei są rozmieszczone w przestrzeni, aby stworzyć sześciokątny kryształ.
Podwójna warstwa
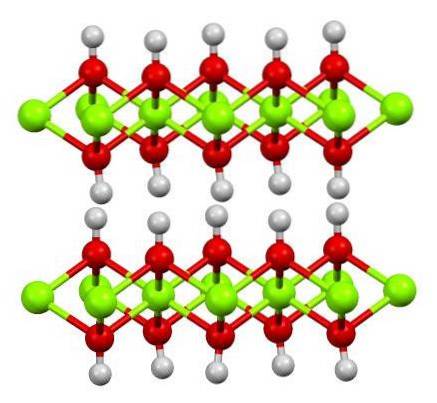
Górny obraz przedstawia dwuwarstwową strukturę wodorotlenku magnezu (LDH): Warstwowe podwójne wodorotlenki). Zielone kule reprezentują jony Mgdwa+, które mogłyby zostać zastąpione innymi z wyższym ładunkiem, aby wygenerować dodatni ładunek w warstwie.
Zauważ, że wokół każdego Mgdwa+ istnieje sześć czerwonych kul połączonych z odpowiednimi białymi kulami; czyli jednostki oktaedryczne Mg (OH)6. OH- działa jak pomost łączący dwa Mgdwa+ różnych płaszczyzn, co sprawia, że warstwy się przeplatają.
Podobnie obserwuje się, że atomy wodoru skierowane są w górę iw dół i są głównie odpowiedzialne za siły międzycząsteczkowe utrzymujące razem dwie warstwy jednostek Mg (OH).6.
Obojętne cząsteczki (takie jak alkohole, amoniak i azot) lub nawet aniony mogą gromadzić się między tymi warstwami, w zależności od tego, jak są dodatnie (jeśli są jony Al3+ o Wiara3+ zastąpienie Mgdwa+). „Wypełniacz” tych gatunków jest ograniczony przez powierzchnie złożone z anionów OH-.
Morfologie
Dwuwarstwowe, sześciokątne szkło rośnie wolno lub szybko. Wszystko zależy od parametrów syntezy lub preparatu: temperatury, stosunku molowego, mieszania, rozpuszczalników, odczynników jako źródła magnezu, zasad lub środków strącających itp. W miarę wzrostu kryształ określa mikrostrukturę lub morfologię swoich nanocząstek lub agregatów.
Zatem te nanocząstki mogą mieć morfologię podobną do kalafiora, płytki lub kuleczki. Podobnie może zmieniać się rozkład ich rozmiarów, a także stopień porowatości otrzymanych ciał stałych..
Nieruchomości
Wygląd fizyczny
Jest to białe, ziarniste lub sproszkowane ciało stałe i bezwonne.
Masa cząsteczkowa
58,3197 g / mol.
Gęstość
3,47 g / ml.
Temperatura topnienia
350 ° C W tej temperaturze rozkłada się na tlenek, uwalniając cząsteczki wody zawarte w jego kryształach:
Mg (OH)dwa(s) => MgO (s) + HdwaO (g)
Rozpuszczalność w wodzie
0,004 g / 100 ml w 100 ° C; to znaczy, ledwo rozpuszcza się we wrzącej wodzie, co czyni go nierozpuszczalnym związkiem w wodzie. Jednak wraz ze spadkiem pH (lub wzrostem kwasowości) jego rozpuszczalność wzrasta z powodu tworzenia się złożonego wodnego roztworu Mg (OHdwa)6.
Z drugiej strony, jeśli Mg (OH)dwa zaabsorbował COdwa, po rozpuszczeniu w kwaśnym środowisku uwalnia zatrzymany gaz w postaci musującej.
Współczynnik załamania światła
1,559
pH
Jej wodna zawiesina ma pH wahające się między 9,5 a 10,5. Chociaż te wartości są normalne, odzwierciedla jego niską zasadowość w porównaniu z innymi wodorotlenkami metali (takimi jak NaOH).
Pojemność cieplna
77,03 J / mol K
Gdzie to się znajduje?

Wodorotlenek magnezu występuje w naturze jako minerał brucyt, który charakteryzuje się przezroczystym białym kolorem, z zielonymi lub niebieskawymi odcieniami w zależności od zawartości zanieczyszczeń. Podobnie brucyt jest częścią niektórych glin, takich jak chloryn, ponieważ jest umieszczony pomiędzy warstwami krzemianów połączonych jonami metali..
W brucycie oprócz Mg znajdują się inne jonydwa+, jak Al3+, Wiara3+, Zndwa+ i Mndwa+. Jego rudy można znaleźć w różnych regionach lub jeziorach Szkocji, Kanady, Włoch i USA..
Fizycznie jego kryształy wyglądają jak stopione szkło (górne zdjęcie), z białymi, szarawymi, niebieskawymi lub zielonkawymi kolorami i przezroczyste w rzadkich okazach.
Ten minerał jest jednym ze zła, które wpływa na cement i beton, ponieważ ma tendencję do rozszerzania się i powodowania w nich pęknięć. Jednak nie pochłania COdwa, dzięki czemu jego kalcynacja nie przyczynia się do efektu cieplarnianego, dlatego jest odpowiednim (i najbogatszym) źródłem mineralogicznym do pozyskiwania magnezu, oprócz wody morskiej.
Nomenklatura
Mg (OH)dwa Ma do trzech nazw zaakceptowanych przez IUPAC (poza mineralogią lub medycyną). Są do siebie bardzo podobne, ponieważ sposób, w jaki kończą, prawie się nie różni..
Na przykład `` wodorotlenek magnezu '' odpowiada swojej nazwie zgodnie z nomenklaturą zapasów, pomijając na końcu (II), ponieważ +2 jest prawie domyślnie jedynym stopniem utlenienia magnezu.
„Diwodorotlenek magnezu”, oznaczający liczbę jonów OH z greckim przedrostkiem licznika- wskazane we wzorze zgodnie z systematyczną nomenklaturą. I „wodorotlenek magnezu” kończący się przyrostkiem -ico oznaczającym maksymalny i „jedyny” stopień utlenienia magnezu, zgodnie z tradycyjną nomenklaturą..
Inne nazwy, takie jak brucyt lub magnezja mleczna, chociaż są bezpośrednio związane z tym związkiem, nie zaleca się nazywania go, jeśli chodzi o jego najczystszą substancję stałą lub związek nieorganiczny (odczynnik, surowiec itp.).
Aplikacje
Neutralizator
Mg (OH)dwa Swoją niską rozpuszczalność w wodzie zawdzięcza temu, że jest doskonałym neutralizatorem kwasowości; w przeciwnym razie bazowałoby to pożywkę przez dostarczanie dużych stężeń jonów OH-, podobnie jak inne zasady (mocne elektrolity).
Zatem Mg (OH)dwa ledwo uwalnia OH-, podczas reakcji z jonami H.3LUB+ z utworzeniem wodnego kompleksu magnezu, również wspomnianego powyżej. Będąc w stanie zneutralizować kwasowość mediów wodnych, jest przeznaczony do oczyszczania ścieków.
Jest również dodatkiem do żywności, nawozów i niektórych produktów higieny osobistej, takich jak pasta do zębów, ponieważ zmniejsza ich kwasowość..
Środek zobojętniający kwas
Ponieważ jest słabo rozpuszczalny w wodzie, może być spożywany bez ryzyka działania jonów OH- (dysocjuje bardzo słabo jako słaby elektrolit).
Ta cecha, powiązana z powyższą podsekcją, sprawia, że jest to środek zobojętniający kwas do leczenia zgagi, chorób żołądkowo-jelitowych, niestrawności i zaparć, sprzedawany w postaci mleka magnezji..
Z drugiej strony mleko magnezji pomaga również zwalczać irytujące owrzodzenia (białe i czerwone rany, które pojawiają się w jamie ustnej).
Ognioodporny
W sekcji właściwości wspomniano, że Mg (OH)dwa rozkłada się, uwalniając wodę. Dokładniej, ta woda pomaga zatrzymać rozprzestrzenianie się płomieni, ponieważ pochłaniają one ciepło, aby odparować, a opary z kolei rozrzedzają palne lub łatwopalne gazy.
W tym celu minerał Brucite jest zwykle używany w przemyśle, przeznaczony jako wypełniacz w niektórych materiałach, takich jak tworzywa sztuczne z różnych polimerów (PVC, żywice, gumy), kable lub sufity..
Katalizator
Mg (OH)dwa zsyntetyzowany w postaci nanopłytek, okazał się skuteczny w katalizowaniu redukcji chemicznych; na przykład 4-nitrofenol (Ph-NOdwa) do 4-aminofenolu (Ph-NHdwa). Mają również działanie przeciwbakteryjne, więc można by je stosować jako środek leczniczy..
Adsorbent
Niektóre ciała stałe Mg (OH)dwa mogą być dość porowate w zależności od sposobu ich przygotowania. Dlatego znajdują zastosowanie jako adsorbenty.
W roztworach wodnych mogą adsorbować (na swoich powierzchniach) cząsteczki barwnika, klarując wodę. Na przykład są zdolne do adsorpcji indygokarminowego barwnika obecnego w strumieniach wody..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Wodorotlenek magnezu. Odzyskane z: en.wikipedia.org
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Wodorotlenek magnezu. Baza danych PubChem. CID = 14791. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Amethyst Galleries. (2014). Mineralny brucyt. Odzyskany z: galleries.com
- Henrist i in. (2003). Badanie morfologiczne nanocząstek wodorotlenku magnezu
- wytrącono w rozcieńczonym wodnym roztworze. Journal of Crystal Growth 249, 321-330.
- Saba J., Shanza R. K., Muhammad R. S. (2018). Synteza i analiza strukturalna mezoporowatych nanocząstek wodorotlenku magnezu jako wydajnego katalizatora.
- Thimmasandra Narayan Ramesh i Vani Pavagada Sreenivasa. (2015). Usuwanie barwnika indygokarminowego z roztworu wodnego przy użyciu wodorotlenku magnezu jako adsorbentu. Journal of Materials, vol. 2015, numer artykułu 753057, 10 stron. doi.org/10.1155/2015/753057



Jeszcze bez komentarzy