
Budowa, synteza, mechanizm działania hormonów steroidowych
Plik hormony steroidowe Są to substancje wytwarzane przez gruczoły wydzielania wewnętrznego, które są zrzucane bezpośrednio do strumienia krążenia, który prowadzi je do tkanek, gdzie wywierają swoje fizjologiczne działanie. Jego nazwa rodzajowa wywodzi się z faktu, że ma jądro steroidowe w swojej podstawowej strukturze..
Cholesterol jest substancją prekursorową, z której syntetyzowane są wszystkie hormony steroidowe, które są podzielone na progestageny (na przykład progesteron), estrogeny (estron), androgeny (testosteron), glukokortykoidy (kortyzol), mineralokortykoidy (aldosteron) i witaminę D.
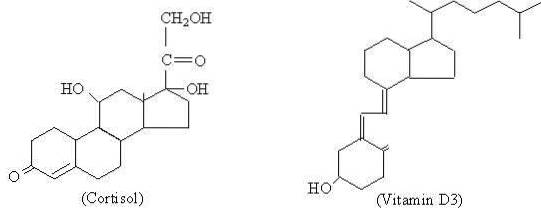
Chociaż różne hormony steroidowe wykazują różnice molekularne między sobą, co nadaje im różne właściwości funkcjonalne, można powiedzieć, że mają one podstawową strukturę, która jest dla nich wspólna i którą reprezentuje cyklopentanoperhydrofenantren o 17 atomach węgla.
Indeks artykułów
- 1 Struktura sterydów
- 1.1 C21
- 1.2 C19
- 1,3 C18
- 2 Synteza
- 2.1 - Synteza na poziomie kory nadnerczy
- 2.2 - Synteza androgenów
- 2.3 - Synteza męskich steroidów płciowych w jądrach
- 2.4 - Synteza żeńskich steroidów płciowych w jajnikach
- 3 Mechanizm działania
- 4 Aldosteron jako przykład
- 5 Referencje
Struktura steroidów
Steroidy to związki organiczne o bardzo zróżnicowanym charakterze, które łączy coś, co można uznać za jądro macierzyste składające się z połączenia trzech pierścieni po sześć atomów węgla (cykloheksany) i jednego z pięciu atomów węgla (cyklopentan).
Ta struktura jest również znana jako „cyklopentaneperhydrofenantren”. Ponieważ pierścienie są ze sobą połączone, całkowita liczba atomów węgla, które go tworzą, wynosi 17; Jednak większość naturalnych steroidów ma grupy metylowe na atomach węgla 13 i 10, które reprezentują odpowiednio węgle 18 i 19..

Wiele naturalnych związków steroidowych ma również jedną lub więcej grup z alkoholową funkcją w strukturze pierścienia i dlatego nazywane są sterolami. Wśród nich jest cholesterol, który ma alkoholową grupę funkcyjną przy węglu 3 i węglowodorowy łańcuch boczny o 8 atomach węgla przyłączonych do węgla 17; atomy ponumerowane od 20 do 27.
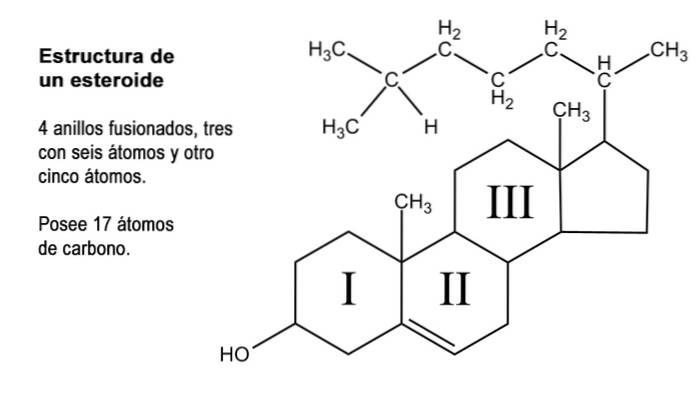
Oprócz tych 17 atomów węgla, hormony steroidowe mogą mieć 1, 2 lub 4 więcej tych atomów w swojej strukturze, dla których rozróżnia się trzy typy steroidów, a mianowicie: C21, C19 i C18.
C21
C21, podobnie jak progesteron i kortykosteroidy nadnerczy (glukokortykoidy i mineralokortykoidy), pochodzą z „pregnanu”. Ma 21 atomów węgla, ponieważ do 17 podstawowego pierścienia dodano dwie grupy metylowe atomów węgla 13 i 10 oraz dwa węgle łańcucha bocznego przyłączonego do C17, który pierwotnie w cholesterolu miał 8 atomów węgla.
C19
C19 odpowiadają hormonom płciowym o działaniu androgennym i pochodzą z „androstanu” (19 atomów węgla), który jest strukturą, która pozostaje, gdy pregnan traci dwa węgle łańcucha bocznego C17, który jest zastępowany grupą hydroksylową lub ketonową.
C18
Steroidy C18 to żeńskie hormony lub estrogeny, które są syntetyzowane głównie w żeńskich gonadach i których wyjątkową cechą, w odniesieniu do pozostałych dwóch typów steroidów, jest brak metylu obecnego w tym ostatnim, przyłączonego do węgla w pozycji 10..
Podczas syntezy z cholesterolu powstają modyfikacje enzymatyczne, które zmieniają liczbę atomów węgla i sprzyjają odwodornieniu i hydroksylacji określonych węgli w strukturze..
Synteza
Komórki produkujące hormony steroidowe zlokalizowane są głównie w korze nadnerczy, gdzie wytwarzane są glukokortykoidy, takie jak kortyzol, mineralokortykoidy, takie jak aldosteron, oraz męskie hormony płciowe, takie jak dehydroepiandrosteron i androstendion..
Męskie gonady płciowe są odpowiedzialne za produkcję androgenów, w tym wyżej wymienionych hormonów i testosteronu, natomiast dojrzewające pęcherzyki jajnikowe wytwarzają progesteron i estrogeny..
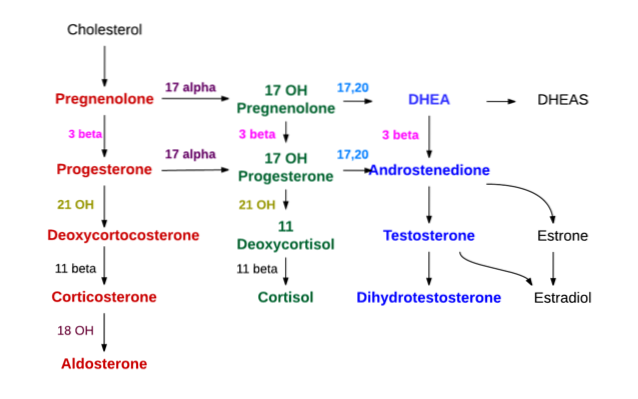
Synteza wszystkich hormonów steroidowych zaczyna się od cholesterolu. Cząsteczka ta może być syntetyzowana przez komórki wytwarzające hormony steroidowe, ale w większości jest ona pozyskiwana przez te komórki z lipoprotein o małej gęstości (LDL) obecnych w krążącym osoczu..
- Synteza na poziomie kory nadnerczy
W korze nadnerczy wyróżnia się trzy warstwy, znane z zewnątrz odpowiednio jako strefa kłębuszkowa, powięziowa i siatkowata..
W kłębuszku nerkowym syntetyzowane są głównie mineralokortykoidy (aldosteron), w pęczkowych glukokortykoidach, takich jak kortykosteron i kortyzol, oraz w androgenach siatkowatych, takich jak dehydroepiandrosteron i androstendion..
Synteza glukokortykoidów
Pierwszy etap syntezy zachodzi w mitochondriach i polega na działaniu enzymu zwanego desmolazą cholesterolu, należącego do nadrodziny cytochromów P450, znanego również jako „P450scc” lub „CYP11A1”, który wspomaga eliminację 6 atomów węgla łańcucha bocznego przymocowanego do C17.
Pod wpływem desmolazy cholesterol (o 27 atomach węgla) przekształca się w pregnenolon, który jest związkiem o 21 atomach węgla i stanowi pierwszy ze steroidów typu C21..
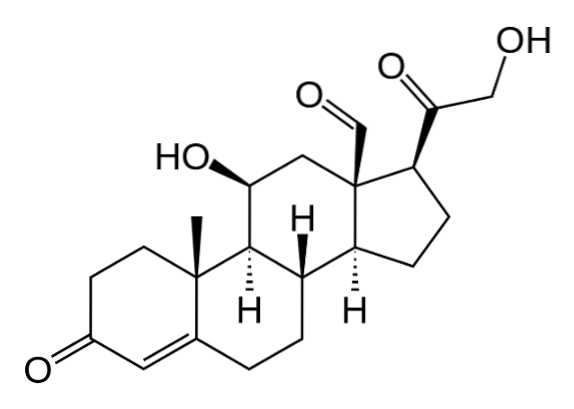
Pregnenolon przenosi się do gładkiej retikulum endoplazmatycznego, gdzie w wyniku działania enzymu dehydrogenazy 3β-hydroksysteroidowej ulega odwodornieniu w hydroksylu grupy alkoholowej węgla 3 i staje się progesteronem.
Dzięki działaniu 21β-hydroksylazy, zwanej także „P450C21” lub „CYP21A2”, progesteron ulega hydroksylacji przy węglu 21 i jest przekształcany w 11-deoksykortykosteron, który powraca do mitochondriów, do którego enzym 11β-hydroksylaza („P450C11 ”Lub„ CYP11B1 ”) przekształca się w kortykosteron.
Inna linia syntezy w strefie pęczkowej, która kończy się nie kortykosteronem, ale kortyzolem, zachodzi, gdy pregnenolon lub progesteron są hydroksylowane w pozycji 17 przez 17α-hydroksylazę („P450C17” lub „CYP17”) i przekształcane 17-hydroksypregnolon lub 17-hydroksyprogesteron.
Ten sam enzym już wspomniany, dehydrogenaza 3β-hydroksysteroidowa, która przekształca pregnenolon w progesteron, również przekształca 17-hydroksypregnolon w 17-hydroksyprogesteron.
Ten ostatni jest przenoszony kolejno przez dwa ostatnie enzymy szlaku, który wytwarza kortykosteron (21β-hydroksylaza i 11β-hydroksylazę) odpowiednio do deoksykortyzolu i kortyzolu..
Działania glukokortykoidów
Głównymi glukokortykoidami wytwarzanymi w warstwowej fascicular kory nadnerczy są kortykosteron i kortyzol. Obie substancje, a zwłaszcza kortyzol, wykazują szerokie spektrum działań, które wpływają na metabolizm, krew, reakcje obronne i gojenie się ran, mineralizację kości, przewód pokarmowy, układ krążenia i płuca..
Jeśli chodzi o metabolizm, kortyzol stymuluje lipolizę i uwalnianie kwasów tłuszczowych, które mogą być wykorzystywane w wątrobie do tworzenia ciał ketonowych i białek o niskiej gęstości (LDL); zmniejsza wychwyt glukozy i lipogenezę w tkance tłuszczowej oraz wychwyt i wykorzystanie glukozy w mięśniach.
Promuje również katabolizm białek na obwodzie: w tkance łącznej, mięśniach i macierzy kostnej, uwalniając w ten sposób aminokwasy, które mogą być wykorzystane w wątrobie do syntezy białek osocza i do glukoneogenezy. Dodatkowo stymuluje jelitowe wchłanianie glukozy poprzez zwiększenie produkcji transporterów SGLT1..
Przyspieszone jelitowe wchłanianie glukozy, zwiększona produkcja wątrobowa i zmniejszone wykorzystanie tego węglowodanu w mięśniach i tkance tłuszczowej sprzyjają podwyższeniu poziomu glukozy w osoczu..
Jeśli chodzi o krew, kortyzol sprzyja procesowi krzepnięcia, stymuluje powstawanie granulocytów obojętnochłonnych i hamuje powstawanie granulocytów granulocytów kwasochłonnych, bazofili, monocytów i limfocytów T. Hamuje również uwalnianie mediatorów stanu zapalnego, takich jak prostaglandyny, interleukiny, limfokiny, histamina i serotonina.
Ogólnie rzecz biorąc, można powiedzieć, że glukokortykoidy zakłócają odpowiedź immunologiczną, z tego powodu mogą być stosowane terapeutycznie w przypadkach, w których ta odpowiedź jest przesadzona lub niewłaściwa, na przykład w przypadku chorób autoimmunologicznych lub przy przeszczepach narządów w celu zmniejszenia odmowa.
- Synteza androgenów
Synteza androgenów na poziomie kory nadnerczy zachodzi głównie na poziomie strefy siatkowatej oraz z 17-hydroksypregnolonu i 17-hydroksyprogesteronu.
Ten sam enzym 17α-hydroksylaza, który wytwarza dwie właśnie wspomniane substancje, ma również aktywność 17,20 liazy, która usuwa dwa atomy węgla łańcucha bocznego C17 i zastępuje je grupą ketonową (= O).
Ta ostatnia czynność zmniejsza liczbę atomów węgla o dwa i wytwarza sterydy typu C19. Jeśli działanie dotyczy 17-hydroksypregnolonu, wynikiem jest dehydroepiandrosteron; jeśli wręcz przeciwnie, substancją dotkniętą chorobą jest hydroksyprogesteron, wówczas produktem będzie androstendion.
Oba związki należą do tak zwanych 17-ketosteroidów, ponieważ mają grupę ketonową przy węglu 17.
Dehydrogenaza 3β-hydroksysteroidowa również przekształca dehydroepiandrosteron w androstendion, ale najczęstszym jest to, że ten pierwszy jest przekształcany w siarczan dehydroepiandrosteronu przez sulfokinazę, obecną prawie wyłącznie w strefie siatkowatej.
Synteza mineralokortykoidów (aldosteron)
Zona glomerularis nie ma enzymu 17α-hydroksylazy i nie może syntetyzować 17-hydroksysteroidowych prekursorów kortyzolu i hormonów płciowych. Nie ma również 11β-hydroksylazy, ale zawiera enzym zwany syntetazą aldosteronu, który może sekwencyjnie wytwarzać kortykosteron, 18-hydroksykortykosteron i mineralokortykoid aldosteron..
Działanie mineralokortykoidów
Najważniejszym mineralokortykoidem jest aldosteron syntetyzowany w warstwie kłębuszkowej kory nadnerczy, ale glukokortykoidy wykazują również aktywność mineralokortykoidów.
Aktywność mineralokortykoidów aldosteronu rozwija się na poziomie nabłonka kanalikowego dystalnego nefronu, gdzie sprzyja reabsorpcji sodu (Na +) i wydzielaniu potasu (K +), przyczyniając się w ten sposób do zachowania odpowiedniego poziomu tych jonów w płynach ustrojowych.
- Synteza męskich steroidów płciowych w jądrach
Synteza androgenów w jądrach zachodzi na poziomie komórek Leydiga. Testosteron jest głównym hormonem androgenowym wytwarzanym w jądrach. Jego synteza obejmuje początkową produkcję androstendionu, jak opisano wcześniej w syntezie androgenów na poziomie kory nadnerczy..
Androstendion przekształca się w testosteron pod działaniem enzymu dehydrogenazy 17β-hydroksysteroidowej, który zastępuje grupę ketonową węgla 17 grupą hydroksylową (OH).
W niektórych tkankach, które służą jako cel dla testosteronu, jest on redukowany przez 5α-reduktazę do dihydrotestosteronu, z większą siłą androgenną.
- Synteza żeńskich steroidów płciowych w jajnikach
Ta synteza zachodzi cyklicznie, towarzysząc zmianom zachodzącym podczas kobiecego cyklu płciowego. Synteza zachodzi w pęcherzyku, który w każdym cyklu dojrzewa, aby uwolnić komórkę jajową, a następnie wytworzyć odpowiednie ciałko żółte.
Estrogeny są syntetyzowane w ziarnistych komórkach dojrzałego pęcherzyka. Dojrzały pęcherzyk ma w swojej osłonce komórki wytwarzające androgeny, takie jak androstendion i testosteron..
Hormony te dyfundują do sąsiednich komórek ziarnistych, które posiadają enzym aromatazy, który przekształca je w estron (E1) i 17β-estradiol (E2). Z obu syntetyzowany jest estriol.
Działanie steroidów płciowych
Główną funkcją androgenów i estrogenów jest rozwój męskich i żeńskich cech płciowych. Androgeny mają działanie anaboliczne sprzyjające syntezie białek strukturalnych, a estrogeny sprzyjają procesowi kostnienia.
Estrogeny i progesteron uwalniane podczas kobiecego cyklu płciowego mają na celu przygotowanie organizmu kobiety do ewentualnej ciąży w wyniku zapłodnienia dojrzałej komórki jajowej uwolnionej podczas owulacji..
Mechanizm akcji
Jeśli potrzebujesz odświeżyć swoją pamięć o mechanizmie działania hormonów, przed kontynuowaniem czytania warto obejrzeć poniższy film.
Mechanizm działania hormonów steroidowych jest u wszystkich dość podobny. W przypadku związków lipofilowych bez trudu rozpuszczają się one w błonie lipidowej i przenikają do cytoplazmy swoich komórek docelowych, które posiadają specyficzne receptory cytoplazmatyczne dla hormonu, na który muszą odpowiadać..
Po utworzeniu kompleksu hormon-receptor przechodzi przez błonę jądrową i wiąże się w genomie, na zasadzie czynnika transkrypcyjnego, z elementem odpowiedzi hormonalnej (HRE) lub genem odpowiedzi pierwotnej, który z kolei może czasami regulować inne geny nazywana odpowiedzią wtórną.
Końcowym rezultatem jest promowanie transkrypcji i syntezy informacyjnego RNA, które ulegają translacji w rybosomach szorstkiej siateczki endoplazmatycznej, które ostatecznie syntetyzują białka indukowane przez hormon..
Przykładem jest aldosteron
Działanie aldosteronu wywierane jest głównie na poziomie końcowej części dystalnej rurki oraz w przewodach zbiorczych, gdzie hormon sprzyja reabsorpcji Na + i wydzielaniu K+.
W błonie luminalnej głównych komórek kanalików tego regionu znajdują się nabłonkowe kanały Na + i K + typu „ROMK”. Nerkowy zewnętrzny rdzeniasty kanał potasowy).
Błona podstawno-boczna ma pompy ATPazy Na + / K +, które w sposób ciągły pobierają Na + z komórki do przestrzeni śródmiąższowej podstawno-bocznej i wprowadzają K + do komórki. Ta aktywność utrzymuje wewnątrzkomórkowe stężenie Na + na bardzo niskim poziomie i sprzyja tworzeniu gradientu stężeń tego jonu między światłem kanalika a komórką..
Ten gradient umożliwia Na + przemieszczanie się w kierunku komórki przez kanał nabłonkowy, a ponieważ Na + przechodzi sam, dla każdego poruszającego się jonu pozostaje nieskompensowany ładunek ujemny, który powoduje, że światło kanalika staje się ujemne w stosunku do śródmiąższu. Oznacza to, że przy ujemnym świetle powstaje przeznabłonkowa różnica potencjałów.
Ta negatywność światła sprzyja wydostawaniu się K +, które przemieszczało się dzięki jego wyższemu stężeniu w komórce, a negatywne światło jest wydzielane do światła kanalika, aby ostatecznie zostać wydalone. To właśnie reabsorpcja Na + i sekrecja K + są regulowane przez działanie aldosteronu..
Aldosteron obecny we krwi i uwolniony z warstwy kłębuszkowej w odpowiedzi na działanie angiotensyny II lub hiperkaliemii przenika do głównych komórek i wiąże się z jej receptorem wewnątrzcytoplazmatycznym.
Kompleks ten dociera do jądra i sprzyja transkrypcji genów, których ekspresja doprowadzi do zwiększenia syntezy i aktywności pomp Na + / K +, nabłonkowych kanałów Na + i kanałów ROMK K +, a także innych białek. Odpowiedź, która będzie miała ogólny wpływ na zatrzymanie Na + w organizmie i zwiększenie wydalania potasu z moczem+.
Bibliografia
- Ganong WF: The Adrenal Medulla & Adrenal Cortex, 25th ed. Nowy Jork, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Adrenocortical Hormones, in Podręcznik fizjologii medycznej , 13 edycja, AC Guyton, JE Hall (red.). Filadelfia, Elsevier Inc., 2016.
- Lang F, Verrey F: Hormone, in Physiologie des Menschen mit Pathophysiologie, 31 wyd., RF Schmidt i wsp. (Red.). Heidelberg, Springer Medizin Verlag, 2010.
- Voigt K: Endokrines System, In: Physiologie, 6th ed; R Klinke i in. (Red.). Stuttgart, Georg Thieme Verlag, 2010.
- Widmaier EP, Raph H and Strang KT: Female Reproductive Physiology, w: Vander's Human Physiology: The Mechanisms of Body Function, wyd. 13; EP Widmaier i in. (Red.). Nowy Jork, McGraw-Hill, 2014.



Jeszcze bez komentarzy