
Przykłady zastosowań prawa akcji masowej
Plik prawo akcji masowej ustala zależność między aktywnymi masami reagentów i produktów, w warunkach równowagi i w układach jednorodnych (roztwory lub fazy gazowe). Został sformułowany przez norweskich naukowców C.M. Guldberg i P. Waage, którzy uznali, że równowaga jest dynamiczna, a nie statyczna.
Dlaczego dynamiczny? Ponieważ szybkości reakcji do przodu i do tyłu są równe. Masy czynne są zwykle wyrażane w mol / l (molarność). Taką reakcję można zapisać tak: aA + bB <=> cC + dD. Dla równowagi wspomnianej w tym przykładzie, związek między reagentami a produktami jest zilustrowany równaniem na poniższym obrazku.
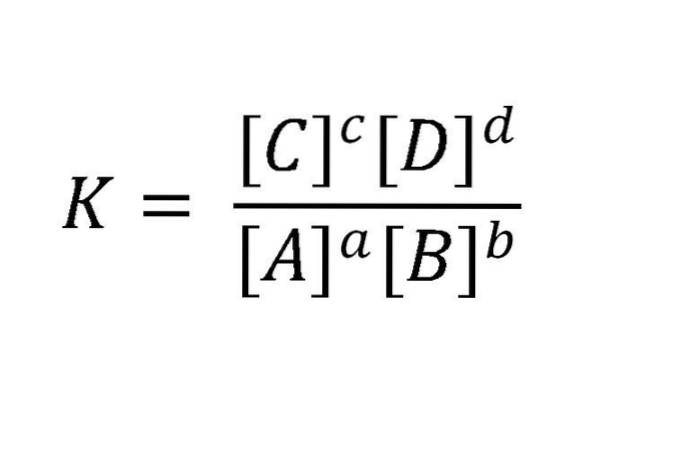
K jest zawsze stała, niezależnie od początkowych stężeń substancji, o ile temperatura się nie zmienia. Tutaj A, B, C i D są reagentami i produktami; podczas gdy a, b, c i d są ich współczynnikami stechiometrycznymi.
Wartość liczbowa K jest stałą charakterystyczną dla każdej reakcji w danej temperaturze. Wtedy K jest tym, co nazywamy stałą równowagi.
Zapis [] oznacza, że w wyrażeniu matematycznym stężenia pojawiają się w jednostkach mol / l, podniesione do potęgi równej współczynnikowi reakcji.
Indeks artykułów
- 1 Jakie jest prawo akcji masowej?
- 1.1 Znaczenie stałej równowagi
- 2 Równowaga chemiczna
- 2.1 Równowaga w układach heterogenicznych
- 2.2 Przemieszczenia równowagi
- 3 Zasada Le Chateliera
- 4 Aplikacje
- 5 Przykłady prawa akcji masowej
- 6 Prawo działania masowego w farmakologii
- 7 Ograniczenia
- 8 Odniesienia
Jakie jest prawo akcji masowej?
Jak wspomniano wcześniej, prawo działania masy wyraża, że prędkość danej reakcji jest wprost proporcjonalna do iloczynu stężeń rodzajów reagentów, gdzie stężenie każdego rodzaju jest podniesione do potęgi równej jej współczynnikowi stechiometrycznemu w substancji chemicznej. równanie.
W tym sensie można to lepiej wyjaśnić, stosując odwracalną reakcję, której ogólne równanie zilustrowano poniżej:
aA + bB ↔ cC + dD
Gdzie A i B reprezentują reagenty, a substancje nazwane C i D reprezentują produkty reakcji. Podobnie wartości a, b, c i d reprezentują współczynniki stechiometryczne odpowiednio A, B, C i D..
Wychodząc z poprzedniego równania, uzyskuje się wspomnianą wcześniej stałą równowagi, którą zilustrowano jako:
K = [C]do[RE]re/[DO]do[B]b
Gdzie stała równowagi K jest równa ilorazowi, w którym licznik składa się z pomnożenia stężeń produktów (w stanie równowagi) podniesionych do ich współczynnika w równaniu zrównoważonym, a mianownik składa się z podobnego mnożenia, ale spośród reagenty podniesione do współczynnika, który im towarzyszy.
Znaczenie stałej równowagi
Należy zauważyć, że w równaniu do obliczenia stałej równowagi należy uwzględnić stężenia substancji w stanie równowagi, o ile nie ma ich modyfikacji ani temperatury układu..
W ten sam sposób wartość stałej równowagi dostarcza informacji o preferowanym kierunku reakcji w stanie równowagi, to znaczy wskazuje, czy reakcja jest korzystna dla reagentów czy produktów..
Jeśli wielkość tej stałej jest znacznie większa niż jedność (K "1), równowaga przesunie się w prawo i będzie faworyzować produkty; natomiast jeśli wielkość tej stałej jest znacznie mniejsza niż jedność (K" 1), równowaga będzie być przechylony w lewo i będzie faworyzować reagenty.
Ponadto, chociaż umownie wskazuje się, że substancje po lewej stronie strzałki są reagentami, a te po prawej stronie są produktami, fakt, że reagenty, które pochodzą z reakcji w bezpośrednim sensie, stają się produktami reakcji. odwrotnie i odwrotnie.
Równowaga chemiczna
Reakcje często osiągają równowagę między ilościami substancji wyjściowych i powstających produktów. Równowaga ta może dodatkowo przesuwać się sprzyjając zwiększaniu lub zmniejszaniu zawartości jednej z substancji biorących udział w reakcji..
Analogiczny fakt zachodzi w przypadku dysocjacji rozpuszczonej substancji: podczas reakcji zanikanie substancji wyjściowych i powstawanie produktów można zaobserwować doświadczalnie ze zmienną prędkością.
Szybkość reakcji w dużym stopniu zależy od temperatury i w różnym stopniu od stężenia reagentów. W rzeczywistości czynniki te są badane szczególnie przez kinetykę chemiczną.
Jednak ta równowaga nie jest statyczna, ale pochodzi ze współistnienia reakcji bezpośredniej i odwrotnej..
W reakcji bezpośredniej (->) powstają produkty, natomiast w reakcji odwrotnej (<-) estos vuelven a originar las sustancias iniciales.
Powyższe stanowi tak zwaną równowagę dynamiczną, o której mowa powyżej..
Równowaga w układach heterogenicznych
W układach heterogenicznych - to znaczy w układach złożonych z kilku faz - stężenia ciał stałych można uznać za stałe, pomijając wyrażenie matematyczne na K.
Złodziej3(s) <=> CaO (s) + COdwa(sol)
Zatem w równowadze rozkładu węglanu wapnia jego stężenie i powstającego tlenku można uznać za stałe niezależnie od jego masy..
Zmiany równowagi
Wartość liczbowa stałej równowagi określa, czy reakcja sprzyja tworzeniu się produktów. Gdy K jest większe niż 1, układ równowagi będzie miał wyższe stężenie produktów niż reagentów, a jeśli K jest mniejsze niż 1, dzieje się odwrotnie: w równowadze stężenie reagentów będzie większe niż produktów..
Zasada Le Chateliera
Wpływ zmian stężenia, temperatury i ciśnienia może zmienić szybkość reakcji.
Na przykład, jeśli w reakcji powstają produkty gazowe, wzrost ciśnienia w układzie powoduje, że reakcja przebiega w przeciwnym kierunku (w kierunku reagentów).
Generalnie reakcje nieorganiczne zachodzące między jonami są bardzo szybkie, podczas gdy organiczne mają znacznie mniejsze prędkości..
Jeśli w reakcji wytwarzane jest ciepło, wzrost temperatury zewnętrznej ma tendencję do zorientowania go w przeciwnym kierunku, ponieważ reakcja odwrotna jest endotermiczna (pochłania ciepło).
Podobnie, jeżeli w jednej z reagujących substancji w układzie w równowadze powstaje nadmiar, inne substancje będą tworzyć produkty, które w jak największym stopniu zneutralizują wspomnianą modyfikację..
W rezultacie równowaga przesuwa się na korzyść w jednym lub drugim kierunku, zwiększając prędkość reakcji, w taki sposób, że wartość K pozostaje stała..
Wszystkie te zewnętrzne wpływy i reakcja równowagi, aby im przeciwdziałać, to tak zwana zasada Le Chateliera..
Aplikacje
Pomimo swojej ogromnej użyteczności, kiedy zaproponowano to prawo, nie wywarło ono pożądanego wpływu ani znaczenia dla społeczności naukowej.
Jednak od XX wieku zyskiwał rozgłos dzięki temu, że kilkadziesiąt lat po jego ogłoszeniu podjęli go ponownie brytyjscy naukowcy William Esson i Vernon Harcourt..
Prawo działań masowych miało z biegiem czasu wiele zastosowań, a niektóre z nich wymieniono poniżej:
- Ponieważ jest sformułowany w kategoriach aktywności, a nie stężeń, przydatne jest określenie odchyleń od idealnego zachowania reagentów w roztworze, o ile jest to zgodne z termodynamiką..
- Gdy reakcja zbliża się do stanu równowagi, można przewidzieć zależność między szybkością netto reakcji a chwilową energią swobodną reakcji Gibbsa..
- W połączeniu z zasadą równowagi szczegółowej, ogólnie rzecz biorąc, prawo to zapewnia wynikowe wartości, zgodnie z termodynamiką, aktywności i stałej w stanie równowagi, a także związek między nimi a wynikającymi z nich stałymi prędkości reakcji w przód i odwrócić kierunki.
- Gdy reakcje są typu elementarnego, stosując to prawo otrzymujemy odpowiednie równanie równowagi dla danej reakcji chemicznej oraz wyrażenia jej szybkości.
Przykłady prawa akcji masowej
-Badając nieodwracalną reakcję między jonami znajdującymi się w roztworze, ogólne wyrażenie tego prawa prowadzi do sformułowania Brönsted-Bjerrum, który określa zależność między siłą jonową gatunku a stałą szybkości.
-Analizując reakcje, które są przeprowadzane w rozcieńczonych roztworach idealnych lub w stanie skupienia gazowego, uzyskuje się ogólny wyraz pierwotnego prawa (dekada lat 80-tych).
-Ponieważ ma uniwersalne cechy, ogólne wyrażenie tego prawa może być używane jako część kinetyki, zamiast postrzegać je jako część termodynamiki.
-W elektronice prawo to służy do określenia, że mnożenie między gęstościami otworów i elektronów na danej powierzchni ma stałą wielkość w stanie równowagi, nawet niezależnie od domieszkowania dostarczanego do materiału..
-Zastosowanie tego prawa do opisu dynamiki między drapieżnikiem a ofiarą jest powszechnie znane, przy założeniu, że stosunek drapieżnictwa do ofiary ma pewną proporcję do relacji między drapieżnikiem a ofiarą..
-W dziedzinie nauk o zdrowiu prawo to można nawet zastosować do opisu pewnych czynników ludzkiego zachowania, z politycznego i społecznego punktu widzenia.
Prawo działania masowego w farmakologii
Zakładając, że D jest lekiem, a R receptorem, na który działa, oba reagują, tworząc kompleks DR, który jest odpowiedzialny za efekt farmakologiczny:
K = [DR] / [D] [R]
K jest stałą dysocjacji. Istnieje bezpośrednia reakcja, w której lek działa na receptor, i inna, w której kompleks DR dysocjuje na oryginalne związki. Każda reakcja ma swoją własną prędkość, dorównuje sobie tylko w stanie równowagi, spełniając K.
Interpretując prawo masy co do litery, im wyższe stężenie D, tym wyższe stężenie utworzonego kompleksu DR..
Jednak wszystkie odbiorniki Rt mają fizyczny limit, więc nie ma nieograniczonej ilości R dla wszystkich dostępnych D. Podobnie badania eksperymentalne z zakresu farmakologii wykazały następujące ograniczenia prawa masowego w tej dziedzinie:
- Zakłada, że wiązanie RD jest odwracalne, podczas gdy w większości przypadków tak naprawdę nie jest..
- Wiązanie R-D może strukturalnie zmienić dowolny z dwóch składników (lek lub receptor), okoliczność, która nie bierze pod uwagę prawa masy.
- Ponadto prawo masowe blednie w obliczu reakcji, w których wielu pośredników interweniuje w tworzeniu rzadkich chorób..
Ograniczenia
Prawo akcji masowej zakłada, że każda reakcja chemiczna ma charakter elementarny; innymi słowy, że molekularność jest taka sama, jak odpowiednia kolejność reakcji dla każdego zaangażowanego gatunku.
Tutaj współczynniki stechiometryczne a, b, c i d są uważane za liczbę cząsteczek zaangażowanych w mechanizm reakcji. Jednak w globalnej reakcji niekoniecznie pokrywają się one z ich kolejnością..
Na przykład dla reakcji aA + bB <=> cC + dD:
Wyrażenie szybkości dla reakcji bezpośrednich i odwrotnych to:
k1= [A]do[B]b
kdwa= [C]do[RE]re
Dotyczy to tylko reakcji elementarnych, ponieważ dla reakcji globalnych, chociaż współczynniki stechiometryczne są poprawne, nie zawsze są one rzędami reakcji. W przypadku reakcji bezpośredniej ta ostatnia mogłaby wyglądać następująco:
k1= [A]w[B]z
W tym wyrażeniu w i z byłyby prawdziwymi porządkami reakcji dla gatunków A i B..
Bibliografia
- Jeffrey Aronson. (19 listopada 2015). Prawa życia: prawo masowego działania Guldberga i Waage'a. Pobrane 10 maja 2018 r. Z: cebm.net
- ScienceHQ. (2018). Prawo akcji masowej. Pobrane 10 maja 2018 r. Z: sciencehq.com
- askiitans. (2018). Prawo akcji masowej i stała równowagi. Pobrane 10 maja 2018 r.Z: askiitians.com
- Salvat Encyclopedia of Sciences. (1968). Chemia. Tom 9, Salvat S.A. edycji Pampeluna, Hiszpania. P 13-16.
- Walter J. Moore. (1963). Chemia fizyczna. W Termodynamika i równowaga chemiczna. (Wydanie czwarte). Longmans. P 169.
- Alex Yartsev. (2018). Prawo działania masowego w farmakodynamice. Pobrane 10 maja 2018 r. Z: derangedphysiology.com

Jeszcze bez komentarzy