
Jednostki miary i eksperymentu prawa Avogadro
Plik Prawo Avogadro postuluje, że równa objętość wszystkich gazów, przy tej samej temperaturze i ciśnieniu, ma taką samą liczbę cząsteczek. Amadeo Avogadro, fizyk włoski, w 1811 roku zaproponował dwie hipotezy: pierwsza mówi, że atomy gazów elementarnych są razem w cząsteczkach zamiast istnieć jako oddzielne atomy, jak powiedział John Dalton..
Druga hipoteza mówi, że równe objętości gazów przy stałym ciśnieniu i temperaturze mają taką samą liczbę cząsteczek. Hipoteza Avogadro dotycząca liczby cząsteczek w gazach została przyjęta dopiero w 1858 r., Kiedy to włoski chemik Stanislao Cannizaro zbudował na tej podstawie logiczny system chemiczny..

Z prawa Avogadro można wywnioskować, że dla danej masy gazu doskonałego jego objętość i liczba cząsteczek są wprost proporcjonalne, jeśli temperatura i ciśnienie są stałe. Oznacza to również, że objętość molowa gazów, które zachowują się idealnie, jest taka sama dla wszystkich.
Na przykład, biorąc pod uwagę liczbę balonów oznaczonych literami od A do Z, wszystkie są napełniane, aż zostaną napompowane do objętości 5 litrów. Każda litera odpowiada innemu gatunkowi gazowemu; to znaczy, że jego cząsteczki mają swoje własne cechy. Prawo Avogadro mówi, że wszystkie balony zawierają taką samą liczbę cząsteczek.
Jeśli balony są teraz napompowane do 10 litrów, zgodnie z hipotezami Avogadro, zostanie wprowadzona podwójna liczba początkowych moli gazowych.
Indeks artykułów
- 1 Z czego się składa i jednostki miary
- 1.1 Odliczenie wartości R wyrażonej w L atm / K mol
- 2 Zwyczajowa forma prawa Avogadro
- 3 Konsekwencje i implikacje
- 4 Pochodzenie
- 4.1 Hipoteza Avogadro
- 4.2 Numer Avogadro
- 5 Eksperyment Avogadro
- 5.1 Eksperymentuj z kontenerami komercyjnymi
- 6 przykładów
- 6,1 O2 + 2H2 => 2H2O
- 6,2 N2 + 3H2 => 2NH3
- 6,3 N2 + O2 => 2NO
- 7 Referencje
Z czego się składa i jednostki miary
Prawo Avogadro mówi, że dla masy gazu doskonałego objętość gazu i liczba moli są wprost proporcjonalne, jeśli temperatura i ciśnienie są stałe. Matematycznie można to wyrazić następującym równaniem:
V / n = K.
V = objętość gazu, zwykle wyrażana w litrach.
n = ilość substancji mierzona w molach.
Również z tzw. Prawa gazu doskonałego mamy:
PV = nRT
P = ciśnienie gazu jest zwykle wyrażane w atmosferach (atm), w mm słupa rtęci (mmHg) lub w paskalach (Pa).
V = objętość gazu wyrażona w litrach (L).
n = liczba moli.
T = temperatura gazu wyrażona w stopniach Celsjusza, Fahrenheita lub Kelvina (0 ºC równa się 273,15 K).
R = uniwersalna stała gazów doskonałych, którą można wyrazić w różnych jednostkach, wśród których wyróżnia się: 0,08205 L atm / K. mol (L atm K-1.kret-1); 8,314 J / K mol (J.K-1.kret-1) (J to dżul); i 1,987 kal./kmol (kal. K.-1.kret-1) (kalorie to kalorie).
Odliczenie wartości R wyrażonej w L.Atm / KKret
Objętość, jaką zajmuje mol gazu w atmosferze ciśnienia i 0 ºC, co odpowiada 273 K, wynosi 22,414 litrów.
R = PV / T
R = 1 atm x 22,414 (L / mol) / (273 ºK)
R = 0,082 L atm / mol K.
Równanie gazu doskonałego (PV = nRT) można zapisać w następujący sposób:
V / n = RT / P
Jeśli przyjmiemy, że temperatura i ciśnienie są stałe, ponieważ R jest stałe, to:
RT / P = K
Później:
V / n = K.
Jest to konsekwencja prawa Avogadro: istnienie stałej zależności między objętością, jaką zajmuje gaz doskonały, a liczbą moli tego gazu, przy stałej temperaturze i ciśnieniu..
Zwyczajowa forma prawa Avogadro
Jeśli masz dwa gazy, powyższe równanie staje się następujące:
V1/ n1= Vdwa/ ndwa
To wyrażenie jest również zapisane jako:
V1/ Vdwa= n1/ ndwa
Z powyższego wynika wskazana zależność proporcjonalności.
W swojej hipotezie Avogadro wskazał, że dwa idealne gazy w tej samej objętości oraz w tej samej temperaturze i ciśnieniu zawierają tę samą liczbę cząsteczek.
To samo dotyczy gazów rzeczywistych; na przykład równa objętość Odwa oraz ndwa zawiera taką samą liczbę cząsteczek, gdy ma tę samą temperaturę i ciśnienie.
Rzeczywiste gazy wykazują niewielkie odchylenia od idealnego zachowania. Jednak prawo Avogadro jest w przybliżeniu ważne dla rzeczywistych gazów przy wystarczająco niskim ciśnieniu i w wysokich temperaturach.
Konsekwencje i implikacje
Najbardziej znaczącą konsekwencją prawa Avogadro jest to, że stała R dla gazów doskonałych ma taką samą wartość dla wszystkich gazów.
R = PV / nT
Więc jeśli R jest stałe dla dwóch gazów:
P.1V1/ nT1= PdwaVdwa/ ndwaTdwa = stała
Przyrostki 1 i 2 reprezentują dwa różne gazy idealne. Wniosek jest taki, że idealna stała gazowa dla 1 mola gazu jest niezależna od rodzaju gazu. Wówczas objętość zajmowana przez tę ilość gazu przy danej temperaturze i ciśnieniu będzie zawsze taka sama.
Konsekwencją zastosowania prawa Avogadro jest ustalenie, że 1 mol gazu zajmuje objętość 22 414 litrów przy ciśnieniu 1 atmosfery i temperaturze 0 ºC (273 K).
Inna oczywista konsekwencja jest następująca: jeśli ciśnienie i temperatura są stałe, to wraz ze wzrostem ilości gazu zwiększa się również jego objętość..
początki
W 1811 roku Avogadro przedstawił swoją hipotezę opartą na teorii atomowej Daltona i prawie Gay-Lussaca dotyczącym wektorów ruchu cząsteczek..
Gay-Lussac doszedł do wniosku w 1809 r., Że „gazy, niezależnie od proporcji, w jakich mogą być połączone, zawsze dają początek związkom, których pierwiastki mierzone w objętości są zawsze wielokrotnościami innego”.
Ten sam autor wykazał również, że „kombinacje gazów zawsze odbywają się według bardzo prostych zależności objętościowych”.
Avogadro zwrócił uwagę, że reakcje chemiczne w fazie gazowej obejmują cząsteczki zarówno reagentów, jak i produktu.
Zgodnie z tym stwierdzeniem związek między reagentem a cząsteczkami produktu musi być liczbą całkowitą, ponieważ istnienie zerwania wiązania przed reakcją (pojedynczych atomów) jest mało prawdopodobne. Jednak ilości molowe można wyrazić za pomocą wartości ułamkowych.
Ze swojej strony prawo objętości kombinacji wskazuje, że zależność liczbowa między objętościami gazów jest również prosta i całkowita. Powoduje to bezpośredni związek między objętościami i liczbą cząsteczek gatunków gazowych..
Hipoteza Avogadro
Avogadro zaproponował, że cząsteczki gazu są dwuatomowe. To wyjaśnia, w jaki sposób dwie objętości wodoru cząsteczkowego łączą się z jedną objętością tlenu cząsteczkowego, dając dwie objętości wody..
Ponadto Avogadro zaproponował, że jeśli równe objętości gazów zawierają taką samą liczbę cząstek, to zależność między gęstością gazów powinna być równa relacji między masami cząsteczkowymi tych cząstek..
Oczywiście podzielenie d1 przez d2 daje iloraz m1 / m2, ponieważ objętość zajmowana przez masy gazowe jest taka sama dla obu gatunków i jest anulowana:
d1 / d2 = (m1 / V) / (m2 / V)
d1 / d2 = m1 / m2
Numer Avogadro
Jeden mol zawiera 6,022 x 102. 3 cząsteczki lub atomy. Liczba ta nazywa się liczbą Avogadro, chociaż to nie on ją obliczył. Jean Pierre, laureat Nagrody Nobla z 1926 r., Dokonał odpowiednich pomiarów i zaproponował nazwę na cześć Avogadro.
Eksperyment Avogadro
Bardzo prosta demonstracja prawa Avogadro polega na umieszczeniu kwasu octowego w szklanej butelce, a następnie dodaniu wodorowęglanu sodu, zamykając wlot butelki balonem, który zapobiega przedostawaniu się lub wypłynięciu gazu z wnętrza butelki.
Kwas octowy reaguje z wodorowęglanem sodu, uwalniając w ten sposób COdwa. Gaz gromadzi się w balonie powodując jego napełnienie. Teoretycznie objętość osiągnięta przez balon jest proporcjonalna do liczby cząsteczek COdwa, zgodnie z prawem Avogadro.
Jednak ten eksperyment ma pewne ograniczenie: balon jest ciałem sprężystym; dlatego, ponieważ jego ściana rozciąga się w wyniku gromadzenia się COdwa, generowana jest w tym siła, która przeciwdziała jego rozciągnięciu i próbuje zmniejszyć objętość balonu.
Eksperymentuj z komercyjnymi kontenerami
Kolejny przykładowy eksperyment prawa Avogadro został przedstawiony z użyciem puszek po napojach i plastikowych butelek..
W przypadku puszek po napojach wlewa się do nich sodę oczyszczoną, a następnie dodaje się roztwór kwasu cytrynowego. Związki reagują ze sobą, uwalniając gaz COdwa, który gromadzi się w puszce.
Następnie dodaje się stężony roztwór wodorotlenku sodu, który ma funkcję „sekwestracji” CO.dwa. Dostęp do wnętrza puszki jest następnie szybko zamykany za pomocą taśmy maskującej.
Po pewnym czasie można zaobserwować, że puszka kurczy się, wskazując, że zmniejszyła się obecność CO.dwa. Wtedy można by pomyśleć, że następuje zmniejszenie objętości puszki, co odpowiada zmniejszeniu liczby cząsteczek CO.dwa, zgodnie z prawem Avogadro.
W eksperymencie z butelką postępuje się tak samo, jak w przypadku puszki po napoju, a po dodaniu NaOH wlot butelki jest zamykany pokrywką; podobnie obserwuje się kurczenie się ścianki butelki. W rezultacie można przeprowadzić taką samą analizę, jak w przypadku puszki po napojach..
Przykłady
Trzy poniższe obrazy ilustrują koncepcję prawa Avogadro, odnoszącego się do objętości zajmowanej przez gazy oraz liczby cząsteczek reagentów i produktów..
LUBdwa + 2Hdwa => 2HdwaLUB
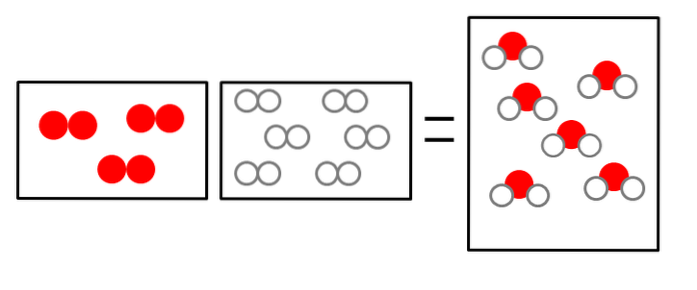
Objętość wodoru jest podwójna, ale zajmuje on ten sam rozmiar co gazowy tlen.
Ndwa + 3Hdwa => 2 NH3
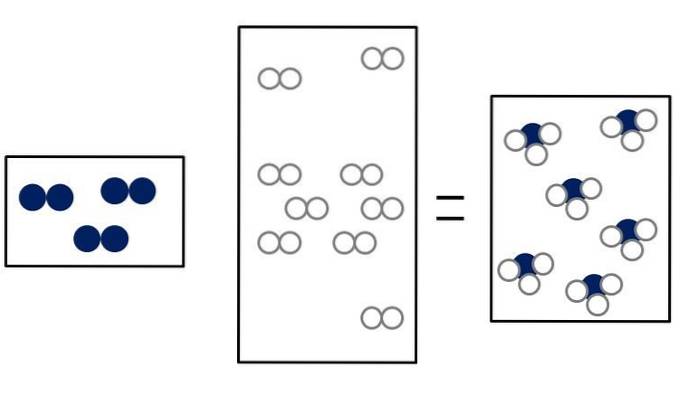
Ndwa + LUBdwa => 2NO

Bibliografia
- Dr Bernard Fernandez (Luty 2009). Dwie hipotezy Avogadro (1811). [PDF]. Zaczerpnięte z: bibnum.education.fr
- Nuria Martínez Medina. (5 lipca 2012). Avogadro, wielki włoski naukowiec XIX wieku. Zaczerpnięte z: rtve.es
- Muñoz R. i Bertomeu Sánchez J.R. (2003) Historia nauki w podręcznikach: hipoteza (y) Avogadro, Teaching science, 21 (1), 147-161.
- Helmenstine, dr Anne Marie (1 lutego 2018). Co to jest prawo Avogadro? Zaczerpnięte z: thinkco.com
- Redaktorzy Encyclopaedia Britannica. (26 października 2016). Prawo Avogadro. Encyclopædia Britannica. Zaczerpnięte z: britannica.com
- Yang, S. P. (2002). Produkty gospodarstwa domowego używane do zawalania zamykanych pojemników i demonstrowania prawa Avogadro. Wychowawca chemii. Tom: 7, strony: 37-39.
- Glasstone, S. (1968). Traktat o chemii fizycznej. dwadaje Ed. Od redakcji Aguilar.


Jeszcze bez komentarzy