
Definicja masy atomowej, rodzaje, sposób obliczania, przykłady

Plik masa atomowa to ilość materii obecna w atomie, którą można wyrazić w zwykłych jednostkach fizycznych lub w atomowych jednostkach masy (uma lub u). Atom jest pusty w większości swojej struktury; elektrony, które są rozproszone w regionach zwanych orbitali, gdzie istnieje pewne prawdopodobieństwo ich znalezienia, a ich jądro.
W jądrze atomu znajdują się protony i neutrony; pierwszy z ładunkami dodatnimi, drugi z ładunkami neutralnymi. Te dwie subatomowe cząstki mają masę znacznie większą niż elektronu; Dlatego masą atomu rządzi jego jądro, a nie próżnia czy elektrony.
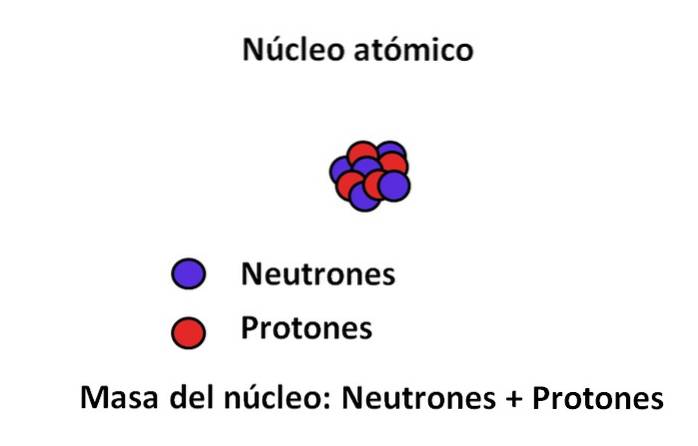
Masa elektronu wynosi około 9,110-31 kg, podczas gdy protonu 1,67 · 10-27 kg, przy czym stosunek masowy wynosił 1800; to znaczy, że proton „waży” 1800 razy więcej niż elektron. Podobnie dzieje się z masami neutronów i elektronów. Dlatego masowy udział elektronu do zwykłych celów uważa się za pomijalny..
Z tego powodu często przyjmuje się, że masa atomu, czyli masa atomowa, zależy tylko od masy jądra; który z kolei składa się z sumy materii neutronów i protonów. Z tego rozumowania wyłaniają się dwa pojęcia: liczba masowa i masa atomowa, obie ściśle ze sobą powiązane..
W atomach jest tak dużo „próżni”, a ponieważ ich masa jest prawie całkowicie funkcją jądra, należy się spodziewać, że to ostatnie jest niezwykle gęste..
Gdybyśmy usunęli tę pustkę z jakiegokolwiek ciała lub przedmiotu, jej wymiary drastycznie się skurczyły. Ponadto, gdybyśmy mogli zbudować mały obiekt oparty na jądrach atomowych (bez elektronów), miałby on masę milionów ton..
Z drugiej strony masy atomowe pomagają rozróżnić różne atomy tego samego pierwiastka; to są izotopy. Ponieważ izotopów jest więcej niż innych, należy oszacować średnią mas atomów dla danego pierwiastka; średnia, która może się różnić w zależności od planety lub regionu przestrzennego.
Indeks artykułów
- 1 Definicja i koncepcja
- 1.1 Jednostka masy atomowej
- 1.2 Równoważność w gramach
- 2 Średnia masa atomowa
- 2.1 Przykład
- 3 Absolutna masa atomowa
- 4 Względna masa atomowa
- 5 Jak obliczyć masę atomową
- 6 przykładów
- 6.1 Węgiel
- 6.2 Sód
- 6.3 Tlen
- 6.4 Azot
- 6.5 Chlor
- 6.6 Dysproz
- 7 Referencje
Definicja i koncepcja
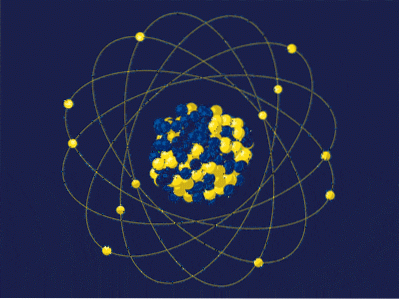
Z definicji masa atomowa jest sumą mas jej protonów i neutronów wyrażoną za pomocą uma lub u. Wynikowa liczba (czasami nazywana również liczbą masową) jest umieszczana bezwymiarowo w lewym górnym rogu w notacji używanej dla nuklidów. Na przykład dla elementu piętnaścieX jego masa atomowa wynosi 15uma lub 15u.
Masa atomowa nie może wiele powiedzieć o prawdziwej tożsamości tego pierwiastka X. Zamiast tego używana jest liczba atomowa, która odpowiada protonom w jądrze X. Jeśli ta liczba wynosi 7, to różnica (15-7) będzie równa 8; to znaczy X ma 7 protonów i 8 neutronów, których suma wynosi 15.
Wracając do obrazu, jądro ma 5 neutronów i 4 protony, więc jego liczba masowa wynosi 9; a z kolei 9 amu to masa jego atomu. Mając 4 protony i sprawdzając układ okresowy, można zauważyć, że to jądro odpowiada pierwiastkowi berylu, Be (lub 9Być).
Jednostka masy atomowej
Atomy są zbyt małe, aby móc zmierzyć ich masy konwencjonalnymi metodami lub zwykłymi wagami. Z tego powodu wynaleziono uma, u lub Da (ślepota na kolory). Te jednostki opracowane dla atomów pozwalają zorientować się, jak masywne są atomy pierwiastka względem siebie..
Ale co dokładnie reprezentuje amu? Musi istnieć odniesienie, które pozwoli na ustalenie relacji masowych. W tym celu atom został użyty jako odniesienie 12C, który jest najbardziej rozpowszechnionym i stabilnym izotopem węgla. Mając 6 protonów (jego liczbę atomową Z) i 6 neutronów, jego masa atomowa wynosi zatem 12.
Zakłada się, że protony i neutrony mają taką samą masę, więc każdy z nich wnosi 1 amu. Jednostka masy atomowej jest wtedy definiowana jako jedna dwunasta (1/12) masy atomu węgla-12; to jest masa protonu lub neutronu.
Równoważność w gramach
A teraz pojawia się następujące pytanie: ile gramów równa się 1 amu? Ponieważ początkowo nie było wystarczająco zaawansowanych technik, aby go zmierzyć, chemicy musieli zadowolić się wyrażaniem wszystkich mas za pomocą amu; była to jednak zaleta, a nie wada.
Dlaczego? Ponieważ cząsteczki subatomowe są tak małe, ich masa wyrażona w gramach musiała być równie mała. W rzeczywistości 1 amu równa się 1,6605 · 10-24 gramy. Dodatkowo, stosując koncepcję mola, nie stanowiło problemu praca mas pierwiastków i ich izotopów z amu wiedząc, że takie jednostki można zmodyfikować do g / mol.
Na przykład wracając do piętnaścieX i 9Bądź, mamy, że ich masy atomowe wynoszą odpowiednio 15 amu i 9 amu. Ponieważ te jednostki są tak małe i nie mówią bezpośrednio, ile materii trzeba "ważyć", aby nimi manipulować, są one przekształcane w ich odpowiednie masy molowe: 15 g / mol i 9 g / mol (wprowadzając pojęcia moli i liczby Avogadro ).
Średnia masa atomowa
Nie wszystkie atomy tego samego pierwiastka mają taką samą masę. Oznacza to, że muszą mieć więcej cząstek subatomowych w jądrze. Będąc tym samym pierwiastkiem, liczba atomowa lub liczba protonów musi pozostać stała; w związku z tym istnieje tylko różnica w ilości posiadanych neutronów.
Tak wynika z definicji izotopów: atomów tego samego pierwiastka, ale o różnych masach atomowych. Na przykład beryl prawie w całości składa się z izotopu 9Bądź, ze śladowymi ilościami 10Być. Jednak ten przykład nie jest zbyt pomocny w zrozumieniu pojęcia średniej masy atomowej; potrzebujemy jednego z większą liczbą izotopów.
Przykład
Załóżmy, że element istnieje 88J, to jest główny izotop J w ilości 60%. J ma również dwa inne izotopy: 86J, z obfitością 20% i 90J, z obfitością również 20%. Oznacza to, że na 100 atomów J, które zbieramy na Ziemi, jest ich 60 88J, a pozostałe 40 to mieszanina 86J i 90jot.
Każdy z trzech izotopów J ma własną masę atomową; to znaczy ich suma neutronów i protonów. Jednak masy te muszą być uśrednione, aby mieć pod ręką masę atomową J; tutaj na Ziemi, ponieważ mogą istnieć inne regiony Wszechświata, w których występuje ich obfitość 86J wynosi 56%, a nie 60%.
Aby obliczyć średnią masę atomową J, należy otrzymać średnią ważoną mas jego izotopów; to znaczy biorąc pod uwagę procent obfitości dla każdego z nich. Mamy więc:
Średnia masa (J) = (86 amu) (0,60) + (88 amu) (0,20) + (90 amu) (0,20)
= 87,2 amu
Oznacza to, że średnia masa atomowa (znana również jako masa atomowa) J wynosi 87,2 amu. Tymczasem jego masa molowa wynosi 87,2 g / mol. Zwróć uwagę, że 87,2 jest bliżej 88 niż 86, a także jest oddalone od 90.
Absolutna masa atomowa
Bezwzględna masa atomowa to masa atomowa wyrażona w gramach. Wychodząc z przykładu hipotetycznego pierwiastka J, możemy obliczyć jego bezwzględną masę atomową (średnią), wiedząc, że każde amu jest równoważne 1,6605 · 10-24 gramy:
Bezwzględna masa atomowa (J) = 87,2 amu * (1,6605 · 10-24 g / rano)
= 1,447956 10-22 g / atom J.
Oznacza to, że średnio atomy J mają masę bezwzględną 1,447956 · 10-22 sol.
Względna masa atomowa
Względna masa atomowa jest liczbowo identyczna ze średnią masą atomową danego pierwiastka; Jednak w przeciwieństwie do drugiej, pierwszej brakuje jedności. Dlatego jest bezwymiarowy. Na przykład średnia masa atomowa berylu wynosi 9,012182 u; podczas gdy jego względna masa atomowa wynosi po prostu 9,012182.
Dlatego te pojęcia są czasami błędnie interpretowane jako synonimy, ponieważ są bardzo podobne, a różnice między nimi są subtelne. Ale do czego odnoszą się te masy? W stosunku do jednej dwunastej masy 12do.
Zatem pierwiastek o względnej masie atomowej 77 oznacza, że ma masę 77 razy większą niż 1/12 12do.
Ci, którzy przyjrzeli się pierwiastkom w układzie okresowym, zobaczą, że ich masy są względnie wyrażone. Nie mają jednostek amu i jest interpretowane jako: żelazo ma masę atomową 55846, co oznacza 55846 razy większą masę niż masa 1/12 masy atomowej. 12C, który można również wyrazić jako 55,846 amu lub 55,846 g / mol.
Jak obliczyć masę atomową
Matematycznie podano przykład, jak to obliczyć na przykładzie elementu J. Ogólnie rzecz biorąc, należy zastosować formułę średniej ważonej, która byłaby:
P = Σ (masa atomowa izotopu) (obfitość w liczbach dziesiętnych)
Innymi słowy, mając masy atomowe (neutrony + protony) każdego izotopu (normalnie naturalnego) dla danego pierwiastka, a także ich odpowiednią ilość na Ziemi (lub jakikolwiek rozważany obszar), można obliczyć wspomnianą średnią ważoną..
A dlaczego nie tylko średnia arytmetyczna? Na przykład średnia masa atomowa J wynosi 87,2 amu. Jeśli ponownie obliczymy tę masę, ale arytmetycznie otrzymamy:
Średnia masa (J) = (88 amu + 86 amu + 90 amu) / 3
= 88 amu
Zauważ, że istnieje ważna różnica między 88 a 87,2. Dzieje się tak, ponieważ średnia arytmetyczna zakłada, że obfitość wszystkich izotopów jest taka sama; Ponieważ istnieją trzy izotopy J, każdy powinien mieć obfitość 100/3 (33,33%). Ale w rzeczywistości tak nie jest: jest znacznie więcej izotopów niż innych.
Dlatego obliczana jest średnia ważona, ponieważ uwzględnia ona, jak obfity jest jeden izotop w drugim..
Przykłady
Węgiel
Aby obliczyć średnią masę atomową węgla, potrzebujemy jego naturalnych izotopów wraz z ich odpowiednimi obfitościami. W przypadku węgla są to: 12C (98,89%) i 13C (1,11%). Ich względne masy atomowe wynoszą odpowiednio 12 i 13, co z kolei jest równe 12 amu i 13 amu. Rozwiązywanie:
Średnia masa atomowa (C) = (12 amu) (0,9889) + (13 amu) (0,0111)
= 12,0111 amu
Dlatego masa atomu węgla wynosi średnio 12,01 amu. Ponieważ istnieją śladowe ilości 14C, prawie nie ma wpływu na tę średnią.
Sód
Wszystkie ziemskie atomy sodu składają się z izotopu 2. 3Na, więc jego obfitość wynosi 100%. Dlatego w zwykłych obliczeniach można przyjąć, że jego masa wynosi po prostu 23 amu lub 23 g / mol. Jednak jego dokładna masa to 22,98976928 amu.
Tlen
Trzy izotopy tlenu w ich odpowiednich ilościach to: 16O (99,762%), 17O (0,038%) i 18O (0,2%). Mamy wszystko, aby obliczyć jego średnią masę atomową:
Średnia masa atomowa (O) = (16 amu) (0,99762) + (17 amu) (0,00038) + (18 amu) (0,002)
= 16,00438 amu
Chociaż podana dokładna masa wynosi w rzeczywistości 15,9994 amu.
Azot
Powtarzając te same kroki z tlenem, mamy: 14N (99,634%) i piętnaścieN (0,366%). Następnie:
Średnia masa atomowa (N) = (14 amu) (0,99634) + (15 amu) (0,00366)
= 14,00366 amu
Zauważ, że podana masa azotu wynosi 14,0067 amu, trochę więcej niż ta, którą obliczyliśmy.
Chlor
Izotopy chloru w ich odpowiednich ilościach to: 35Cl (75,77%) i 37Cl (24,23%). Obliczając jego średnią masę atomową otrzymujemy:
Średnia masa atomowa (Cl) = (35 amu) (0,7577) + (37 amu) (0,2423)
= 35,4846 amu
Bardzo podobny do zgłoszonego (35,453 amu).
Dysproz
Na koniec zostanie obliczona średnia masa pierwiastka z wieloma naturalnymi izotopami: dysproz. Są to i wraz z ich odpowiednią obfitością: 156Dy (0,06%), 158Dy (0,10%), 160Dy (2,34%), 161Dy (18,91%), 162Dy (25,51%), 163Dy (24,90%) i 164Dy (28,18%).
Postępujemy jak w poprzednich przykładach, aby obliczyć masę atomową tego metalu:
Średnia masa atomowa (Dy) = (156 amu) (0,0006%) + (158 amu) (0,0010) + (160 amu) (0,0234) + (161 amu) (0,1891) + (162 amu) (0,2551) + (163 amu) (0,2490) + (164 amu) (0,2818)
= 162,5691 amu
Zgłoszona masa to 162500 amu. Zauważ, że ta średnia wynosi od 162 do 163, ponieważ izotopy 156Dy, 158Dy i 160Dy są nieliczne; podczas gdy te, które dominują, są 162Dy, 163Dy i 164Dy.
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Wikipedia. (2019). Masa atomowa. Odzyskane z: en.wikipedia.org
- Christopher Masi. (s.f.). Masa atomowa. Odzyskany z: wsc.mass.edu
- Natalie Wolchover. (12 września 2017). Jak ważysz atom? Nauka na żywo. Odzyskane z: livescience.com
- Chemia LibreTexts. (05 czerwca 2019). Obliczanie mas atomowych. Odzyskane z: chem.libretexts.orgs
- Edward Wichers i H. Steffen Peiser. (15 grudnia 2017). Masa atomowa. Encyclopædia Britannica. Odzyskany z: britannica.com


Jeszcze bez komentarzy