
Pojęcie i wzór na objętość molową, obliczenia i przykłady
Plik objętość molowa Jest to intensywna właściwość, która wskazuje, ile miejsca zajmuje kret określonej substancji lub związku. Jest reprezentowany przez symbol V.m, y jest wyrażone w jednostkach dm3/ mol dla gazów i cm3/ mol dla cieczy i ciał stałych, ponieważ te ostatnie są bardziej ograniczone przez ich wyższe siły międzycząsteczkowe.
Ta właściwość powtarza się podczas badania układów termodynamicznych zawierających gazy; ponieważ dla cieczy i ciał stałych równania do wyznaczenia Vm stają się bardziej skomplikowane i niedokładne. Dlatego, jeśli chodzi o kursy podstawowe, objętość molowa jest zawsze związana z teorią gazu doskonałego..
Wynika to z faktu, że aspekty strukturalne nie mają znaczenia dla gazów idealnych lub doskonałych; wszystkie jego cząsteczki są wizualizowane jako kule, które elastycznie zderzają się ze sobą i zachowują się w ten sam sposób bez względu na ich masę lub właściwości.
W takim przypadku mol dowolnego gazu doskonałego będzie zajmował, przy danym ciśnieniu i temperaturze, tę samą objętość V.m. Mówi się wtedy, że w normalnych warunkach odpowiednio P i T, 1 atm i 0 ºC, jeden mol gazu doskonałego zajmie objętość 22,4 litra. Ta wartość jest przydatna i przybliżona nawet przy ocenie gazów rzeczywistych.
Indeks artykułów
- 1 Pojęcie i formuła
- 1.1 Dla gazów
- 1.2 Do cieczy i ciał stałych
- 2 Jak obliczyć objętość molową?
- 3 Przykłady obliczania objętości molowej
- 3.1 Przykład 1
- 3.2 Ćwiczenie 2
- 3.3 Ćwiczenie 3
- 4 Odnośniki
Koncepcja i formuła
Do gazów
Bezpośredni wzór do obliczenia objętości molowej gatunku to:
Vm = V / n
Gdzie V jest objętością, którą zajmuje, i n ilość gatunku w pieprzykach. Problem w tym, że Vm zależy od ciśnienia i temperatury, których doświadczają cząsteczki, i pożądane jest wyrażenie matematyczne uwzględniające te zmienne.
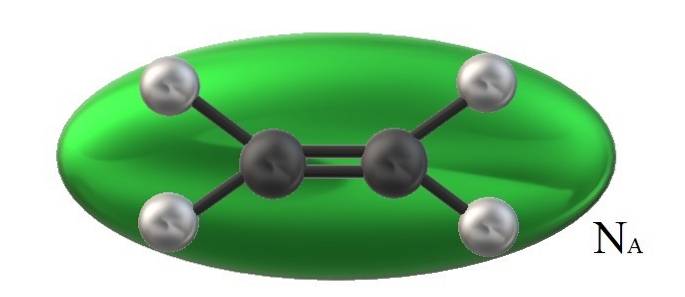
Etylen na obrazku, H.dwaC = CHdwa, ma związaną z nim objętość cząsteczkową ograniczoną zieloną elipsoidą. Ten H.dwaC = CHdwa Może obracać się na wiele sposobów, co jest tak, jakby wspomniana elipsoida została przesunięta w przestrzeni, aby zwizualizować, jaką objętość zajmie (oczywiście nieistotna).
Jeśli jednak objętość takiej zielonej elipsoidy pomnożymy ją przez NDO, Liczba Avogadro, wtedy będziemy mieli jeden mol cząsteczek etylenu; jeden mol oddziałujących ze sobą elipsoid. W wyższych temperaturach cząsteczki oddzielą się od siebie; podczas gdy przy wyższym ciśnieniu będą się kurczyć i zmniejszać swoją objętość.
Dlatego Vm jest zależny od P i T. Etylen ma geometrię płaską, więc nie można sądzić, że jego Vm jest dokładnie i dokładnie taki sam jak metan, CH4, o geometrii czworościennej, którą można przedstawić za pomocą kuli, a nie elipsoidy.
Do cieczy i ciał stałych
Cząsteczki lub atomy cieczy i ciał stałych również mają swoje własne V.m, co można z grubsza powiązać z jego gęstością:
Vm = m / (dn)
Temperatura wpływa na objętość molową cieczy i ciał stałych bardziej niż ciśnienie, o ile to ostatnie nie zmienia się gwałtownie lub jest wygórowane (rzędu GPa). Podobnie, jak wspomniano w przypadku etylenu, geometrie i struktury molekularne mają duży wpływ na wartości Vm.
Jednak w normalnych warunkach obserwuje się, że gęstości różnych cieczy lub ciał stałych nie zmieniają się zbytnio pod względem ich wielkości; to samo dotyczy objętości molowych. Zauważ, że im gęstsze, tym mniejsze będzie Vm.
Jeśli chodzi o ciała stałe, ich objętość molowa zależy również od ich struktur krystalicznych (objętości ich komórki elementarnej)..
Jak obliczyć objętość molową?
W przeciwieństwie do cieczy i ciał stałych, dla gazów doskonałych istnieje równanie, które pozwala nam obliczyć Vm w funkcji P i T oraz ich zmian; to znaczy gazów doskonałych:
P = nRT / V
Co jest przystosowane do wyrażenia V / n:
V / n = RT / P
Vm = RT / P
Jeśli użyjemy stałej gazowej R = 0,082 L atm K.-1Kret-1, wtedy temperatury należy wyrazić w kelwinach (K), a ciśnienie w atmosferach. Zauważ, że tutaj możemy zobaczyć, dlaczego V.m jest właściwością intensywną: T i P nie mają nic wspólnego z masą gazu, ale z jego objętością.
Obliczenia te są ważne tylko w warunkach, w których gazy zachowują się blisko ideału. Jednak wartości uzyskane w wyniku eksperymentów mają niewielki margines błędu w stosunku do wartości teoretycznych.
Przykłady obliczania objętości molowej
Przykład 1
Istnieje gaz Y, którego gęstość wynosi 8,5 · 10-4 g / cm3. Jeśli mamy 16 gramów, co odpowiada 0,92 molom Y, oblicz jego objętość molową.
Ze wzoru na gęstość możemy obliczyć, jaką objętość Y zajmują te 16 gramów:
V = 16 g / (8,5 · 10-4 g / cm3)
= 18,823,52 cm3 lub 18,82 l
Więc Vm Oblicza się go bezpośrednio, dzieląc tę objętość przez liczbę podanych moli:
Vm = 18,82 l / 0,92 mol
= 20,45 l / mol lub L mol-1 lub dm3Kret-1
Ćwiczenie 2
W poprzednim przykładzie Y nigdy nie określono, jakiej temperatury doświadczają cząsteczki wspomnianego gazu. Zakładając, że Y pracował pod ciśnieniem atmosferycznym, obliczyć temperaturę niezbędną do ściśnięcia go do określonej objętości molowej.
Oświadczenie z ćwiczenia jest dłuższe niż jego uchwała. Używamy równania:
Vm = RT / P
Ale rozwiązujemy T i wiedząc, że ciśnienie atmosferyczne wynosi 1 atm, rozwiązujemy:
T = VmP / R
= (20,45 L / mol) (1 atm) / (0,082 L atm / K mol)
= 249,39 K
Oznacza to, że jeden mol Y zajmie 20,45 litra w temperaturze bliskiej -23,76 ° C.
Ćwiczenie 3
Zgodnie z poprzednimi wynikami, określ Vm w temperaturze 0 ° C, 25 ° C i przy zera absolutnym przy ciśnieniu atmosferycznym.
Przekształcając temperatury na kelwinów, mamy najpierw 273,17 K, 298,15 K i 0 K.Rozwiązujemy bezpośrednio, podstawiając pierwszą i drugą temperaturę:
Vm = RT / P
= (0,082 L atm / K mol) (273,15 K) / 1 atm
= 22,40 l / mol (0 ºC)
= (0,082 L atm / K mol) (298,15 K) / 1 atm
= 24,45 l / mol (25ºC)
Na początku wspomniano o wartości 22,4 litra. Zwróć uwagę, jak Vm rośnie wraz z temperaturą. Kiedy chcemy wykonać te same obliczenia dla zera absolutnego, napotykamy trzecią zasadę termodynamiki:
(0,082 L atm / K mol) (0 K) / 1 atm
= 0 l / mol (-273,15 ºC)
Gaz Y nie może mieć nieistniejącej objętości molowej; oznacza to, że został przekształcony w ciecz i poprzednie równanie nie jest już aktualne.
Z drugiej strony niemożność obliczenia Vm w zera absolutnego spełnia trzecią zasadę termodynamiki, która mówi, że nie można schłodzić żadnej substancji do temperatury zera absolutnego.
Bibliografia
- Ira N. Levine. (2014). Zasady fizykochemii. Szósta edycja. Mc Graw Hill.
- Glasstone. (1970). Traktat chemii fizycznej. Druga edycja. Aguilar.
- Wikipedia. (2019). Objętość molowa. Odzyskane z: en.wikipedia.org
- Helmenstine, dr Anne Marie (08 sierpnia 2019). Definicja objętości molowej w chemii. Odzyskany z: thinkco.com
- BYJU. (2019). Formuła objętości molowej. Odzyskany z: byjus.com
- González Monica. (28 października 2010). Objętość molowa. Odzyskany z: quimica.laguia2000.com



Jeszcze bez komentarzy