
Struktura, właściwości, zagrożenia, zastosowania trójtlenku siarki (SO3)

Plik trójtlenek siarki Jest to związek nieorganiczny powstały w wyniku połączenia atomu siarki (S) i 3 atomów tlenu (O). Jego wzór cząsteczkowy to SO3. W temperaturze pokojowej SO3 jest to ciecz, która uwalnia gazy do powietrza.
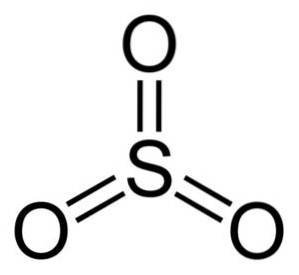
Struktura systemu operacyjnego3 gaz jest płaski i symetryczny. Wszystkie trzy tlenki są jednakowo rozmieszczone wokół siarki. SO3 Reaguje gwałtownie z wodą. Reakcja jest egzotermiczna, co oznacza, że wytwarzane jest ciepło, innymi słowy, bardzo się nagrzewa.
Kiedy SO3 ciecz schładza się, zamienia się w ciało stałe, które może mieć trzy rodzaje struktury: alfa, beta i gamma. Najbardziej stabilna jest alfa, w postaci połączonych ze sobą warstw tworzących sieć.
Gazowy trójtlenek siarki jest używany do wytwarzania dymiącego kwasu siarkowego, zwanego również oleum, ze względu na jego podobieństwo do olejów lub substancji oleistych. Innym z jego ważnych zastosowań jest sulfonowanie związków organicznych, czyli dodawanie grup -SO3- do tych. W ten sposób można przygotować przydatne chemikalia, takie jak między innymi detergenty, barwniki, pestycydy..
SO3 Jest bardzo niebezpieczny, może powodować poważne oparzenia, uszkodzenia oczu i skóry. Nie należy go również wdychać ani połykać, ponieważ może spowodować śmierć z powodu oparzeń wewnętrznych jamy ustnej, przełyku, żołądka itp..
Z tych powodów należy obchodzić się z nim z dużą ostrożnością. Nigdy nie powinien mieć kontaktu z wodą lub materiałami palnymi, takimi jak drewno, papier, tkaniny itp., Ponieważ może dojść do pożaru. Nie należy go też usuwać ani przedostawać do kanalizacji ze względu na niebezpieczeństwo wybuchu.
SO3 Gaz powstający w procesach przemysłowych nie powinien być uwalniany do środowiska, ponieważ jest jednym z czynników odpowiedzialnych za kwaśne deszcze, które zniszczyły już duże obszary lasów na świecie..
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości fizyczne
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Punkt potrójny
- 3.5 Temperatura wrzenia
- 3.6 Gęstość
- 3.7 Prężność par
- 3.8 Stabilność
- 4 Właściwości chemiczne
- 5 Otrzymywanie
- 6 zastosowań
- 6.1 W przygotowaniu oleum
- 6.2 W reakcjach chemicznych sulfonowania
- 6.3 Przy wydobywaniu metali
- 6.4 W różnych zastosowaniach
- 7 Ryzyka
- 7.1 Dla zdrowia
- 7.2 Od pożaru lub wybuchu
- 8 Wpływ na środowisko
- 9 Odniesienia
Struktura
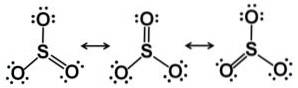
Cząsteczka trójtlenku siarki SO3 w stanie gazowym ma płaską trójkątną strukturę.
Oznacza to, że zarówno siarka, jak i trzy tlenki znajdują się w tej samej płaszczyźnie. Ponadto rozkład tlenu i wszystkich elektronów jest symetryczny.
W stanie stałym znane są trzy rodzaje struktury SO3: alfa (α-SO3), beta (β-SO3) i gamma (γ-SO3).
Postać gamma γ-SO3 zawiera cykliczne trimery, czyli trzy jednostki SO3 razem tworząc cząsteczkę cykliczną lub pierścieniową.
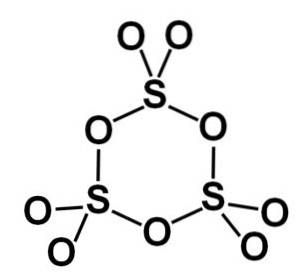
Faza beta β-SO3 posiada nieskończone helikalne łańcuchy czworościanów o składzie SO4 połączone ze sobą.
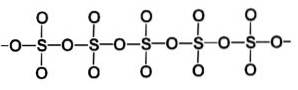
Najbardziej stabilną formą jest alfa α-SO3, podobny do beta, ale z warstwową strukturą, z łańcuchami połączonymi w sieć.
Nomenklatura
-Trójtlenek siarki
-Bezwodnik siarkowy
-Tlenek siarki
-południowy zachód3 gamma, γ-SO3
-południowy zachód3 beta, β-SO3
-południowy zachód3 alfa, α-SO3
Właściwości fizyczne
Stan fizyczny
W temperaturze pokojowej (około 25 ºC) i ciśnieniu atmosferycznym SO3 jest to bezbarwna ciecz, która wydziela opary do powietrza.
Kiedy SO3 ciecz jest czysta w temperaturze 25 ºC jest mieszaniną SO3 monomeryczny (pojedyncza cząsteczka) i trimeryczny (dołączone 3 cząsteczki) o wzorze S3LUB9, zwany także SO3 gamma γ-SO3.
Gdy temperatura spada, jeśli SO3 jest czysty, gdy osiągnie 16,86 ºC, krzepnie lub zamarza do γ-SO3, zwany także „SO ice”3".
Jeśli zawiera niewielkie ilości wilgoci (nawet ślady lub bardzo małe ilości), SO3 polimeryzuje do postaci beta β-SO3 który tworzy kryształy o jedwabistym połysku.
Wówczas powstaje więcej wiązań tworzących strukturę alfa α-SO3, który jest krystalicznym ciałem stałym w kształcie igły, przypominającym azbest lub azbest.
Kiedy alfa i beta łączą się, generują gamma.
Waga molekularna
80,07 g / mol
Temperatura topnienia
południowy zachód3 gamma = 16,86 ºC
Potrójny punkt
Jest to temperatura, w której występują trzy stany skupienia: ciało stałe, ciecz i gaz. W formie alfa punkt potrójny ma temperaturę 62,2 ºC, a w fazie beta 32,5 ºC.
Ogrzewanie formy alfa ma większą tendencję do sublimacji niż do topienia. Sublimacja oznacza bezpośrednie przejście ze stanu stałego do stanu gazowego, bez przechodzenia przez stan ciekły.
Temperatura wrzenia
Wszystkie formy systemu operacyjnego3 gotować w 44,8 ºC.
Gęstość
SO3 ciecz (gamma) ma gęstość 1,9225 g / cm3 przy 20 ºC.
SO3 gaz ma gęstość 2,76 względem powietrza (powietrze = 1), co oznacza, że jest cięższy od powietrza.
Ciśnienie pary
południowy zachód3 alfa = 73 mm Hg w 25 ° C
południowy zachód3 beta = 344 mm Hg w 25 ° C
południowy zachód3 gamma = 433 mm Hg przy 25 ºC
Oznacza to, że forma gamma ma tendencję do łatwiejszego parowania niż beta, a ta niż alfa..
Stabilność
Forma alfa jest najbardziej stabilną strukturą, pozostałe są metastabilne, to znaczy są mniej stabilne.
Właściwości chemiczne
SO3 reaguje energicznie z wodą, dając kwas siarkowy H.dwapołudniowy zachód4. Podczas reakcji wytwarza się dużo ciepła, dlatego z mieszaniny szybko uwalnia się para wodna.
Będąc wystawionym na działanie powietrza SO3 szybko wchłania wilgoć, wydzielając gęste opary.
Jest bardzo silnym środkiem odwadniającym, co oznacza, że łatwo usuwa wodę z innych materiałów.
Siarka w SO3 ma powinowactwo do wolnych elektronów (czyli elektronów, które nie są w wiązaniu między dwoma atomami), więc ma tendencję do tworzenia kompleksów ze związkami, które je posiadają, takimi jak pirydyna, trimetyloamina lub dioksan.
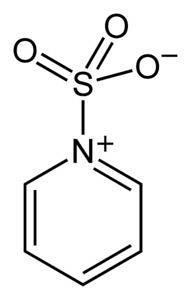
Tworząc kompleksy, siarka „pożycza” elektrony od innego związku, aby wypełnić ich brak. W tych kompleksach nadal dostępny jest trójtlenek siarki, który jest używany w reakcjach chemicznych do dostarczania SO3.
Jest silnym odczynnikiem sulfonującym dla związków organicznych, co oznacza, że jest używany do łatwego dodawania grupy -SO3- do cząsteczek.
Łatwo reaguje z tlenkami wielu metali, tworząc siarczany tych metali.
Działa korodująco na metale, tkanki zwierzęce i roślinne.
SO3 Jest materiałem trudnym w obróbce z kilku powodów: (1) jego temperatura wrzenia jest stosunkowo niska, (2) ma tendencję do tworzenia stałych polimerów w temperaturach poniżej 30 ºC oraz (3) ma wysoką reaktywność w stosunku do prawie wszystkich związków organicznych substancje i wodę.
Może polimeryzować wybuchowo, jeśli nie zawiera stabilizatora i występuje wilgoć. Jako stabilizatory stosuje się siarczan dimetylu lub tlenek boru..
Otrzymywanie
Uzyskuje się go w wyniku reakcji w temperaturze 400 ºC między dwutlenkiem siarki SOdwa i tlen cząsteczkowy Odwa. Jednak reakcja przebiega bardzo wolno i do zwiększenia szybkości reakcji potrzebne są katalizatory..
2 SOdwa + LUBdwa ⇔ 2 SO3
Wśród związków przyspieszających tę reakcję znajduje się platynowo-metaliczny Pt, pięciotlenek wanadu VdwaLUB5, tlenek żelaza FedwaLUB3 i tlenek azotu NO.
Aplikacje
W przygotowaniu oleum
Jednym z jego głównych zastosowań jest otrzymywanie oleum czyli dymiącego kwasu siarkowego, zwanego tak, ponieważ wydziela opary widoczne gołym okiem. Aby go uzyskać, SO jest absorbowana3 w stężonym kwasie siarkowym H.dwapołudniowy zachód4.

Odbywa się to w specjalnych wieżach ze stali nierdzewnej, w których stężony kwas siarkowy (który jest płynny) opada i SO3 soda rośnie.
Ciecz i gaz wchodzą w kontakt i łączą się, tworząc oleum, które jest oleistą cieczą. Zawiera mieszaninę H.dwapołudniowy zachód4 A więc3, ale ma również cząsteczki kwasu disiarkowego HdwaSdwaLUB7 i trójsiarkowy H.dwaS3LUB10.
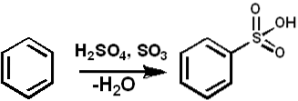
W reakcjach chemicznych sulfonowania
Sulfonowanie jest kluczowym procesem w zastosowaniach przemysłowych na dużą skalę do produkcji detergentów, środków powierzchniowo czynnych, barwników, pestycydów i farmaceutyków..
SO3 służy jako środek sulfonujący do wytwarzania między innymi sulfonowanych olejów i detergentów alkilo-arylosulfonowanych. Poniżej przedstawiono reakcję sulfonowania związku aromatycznego:
ArH + SO3 → ArSO3H.
Do reakcji sulfonowania można stosować oleum lub SO.3 w postaci jej kompleksów m.in. z pirydyną lub trimetyloaminą.
W wydobyciu metali
Gaz SO3 Został użyty w leczeniu minerałów. Proste tlenki metali mogą stać się znacznie bardziej rozpuszczalnymi siarczanami po potraktowaniu ich SO3 w stosunkowo niskich temperaturach.
Minerały siarczkowe, takie jak piryt (siarczek żelaza), chalkozyna (siarczek miedzi) i milleryt (siarczek niklu) są najbardziej ekonomicznymi źródłami metali nieżelaznych, dlatego obróbka za pomocą SO3 umożliwia łatwe i tanie uzyskanie tych metali.
Siarczki żelaza, niklu i miedzi reagują z gazem SO3 nawet w temperaturze pokojowej, tworząc odpowiednie siarczany, które są bardzo dobrze rozpuszczalne i można je poddać innym procesom w celu uzyskania czystego metalu.
W różnych zastosowaniach
SO3 służy do otrzymywania kwasu chlorosulfonowego zwanego również kwasem chlorosulfonowym HSO3Cl.
Trójtlenek siarki jest bardzo silnym utleniaczem i jest używany do produkcji materiałów wybuchowych..
Ryzyka
Za zdrowie
SO3 Jest związkiem silnie toksycznym we wszystkich drogach tj. Przez wdychanie, połknięcie i kontakt ze skórą.
Działa drażniąco i korodująco na błony śluzowe. Powoduje oparzenia skóry i oczu. Jego opary są bardzo toksyczne przy wdychaniu. Występują oparzenia wewnętrzne, duszność, ból w klatce piersiowej i obrzęk płuc.

To jest trujące. Jego połknięcie powoduje poważne oparzenia jamy ustnej, przełyku i żołądka. Ponadto podejrzewa się, że jest rakotwórczy.
Od pożaru lub eksplozji
Stanowi zagrożenie pożarowe w kontakcie z materiałami pochodzenia organicznego, takimi jak między innymi drewno, włókna, papier, olej, bawełna, zwłaszcza jeśli są mokre..
Istnieje również ryzyko w przypadku kontaktu z zasadami lub środkami redukującymi. Łączy się z wodą wybuchowo tworząc kwas siarkowy.
W kontakcie z metalami może wytworzyć się wodór w postaci gazowego Hdwa który jest bardzo łatwopalny.
Należy unikać podgrzewania w szklanych słoikach, aby zapobiec możliwemu gwałtownemu pęknięciu pojemnika..
Wpływ środowiska
SO3 Jest uważany za jeden z głównych zanieczyszczeń obecnych w ziemskiej atmosferze. Wynika to z jego roli w tworzeniu się aerozoli i jego udziału w kwaśnych deszczach (w wyniku tworzenia się kwasu siarkowego Hdwapołudniowy zachód4).

SO3 powstaje w atmosferze w wyniku utleniania dwutlenku siarki SOdwa. Tworząc SO3 reaguje szybko z wodą, tworząc kwas siarkowy H.dwapołudniowy zachód4. Według ostatnich badań istnieją inne mechanizmy przemian SO3 w atmosferze, ale ze względu na dużą ilość występującej w niej wody nadal uważa się, że jest znacznie bardziej prawdopodobne niż SO3 staje się przede wszystkim H.dwapołudniowy zachód4.
SO3 Zawierające go gazowe lub gazowe odpady przemysłowe nie powinny być wypuszczane do atmosfery, ponieważ są niebezpiecznym zanieczyszczeniem. Jest to gaz silnie reaktywny i, jak już zostało powiedziane, w obecności wilgoci w powietrzu SO3 staje się kwasem siarkowym Hdwapołudniowy zachód4. Dlatego w powietrzu SO3 utrzymuje się w postaci kwasu siarkowego tworząc małe kropelki lub aerozol.
Jeśli kropelki kwasu siarkowego dostaną się do dróg oddechowych ludzi lub zwierząt, ze względu na obecną tam wilgoć szybko rosną, więc mają szansę przedostać się do płuc. Jeden z mechanizmów, dzięki którym kwaśna mgła H.dwapołudniowy zachód4 (tj. SO3) może powodować silną toksyczność, ponieważ zmienia zewnątrzkomórkowe i wewnątrzkomórkowe pH organizmów żywych (roślin, zwierząt i ludzi).
Według niektórych badaczy mgła z SO3 To jest przyczyną wzrostu zachorowań na astmę w Japonii. WIĘC mgła3 Ma bardzo korozyjny wpływ na metale, przez co konstrukcje metalowe budowane przez ludzi, takie jak niektóre mosty i budynki, mogą zostać poważnie uszkodzone..
SO3 Płynów nie należy usuwać do kanalizacji ani kanalizacji. Rozlany do kanalizacji może spowodować pożar lub zagrożenie wybuchem. W razie przypadkowego rozlania nie kierować strumienia wody na produkt. Nigdy nie powinien być wchłaniany przez trociny lub inne palne absorbenty, ponieważ może spowodować pożar.
Należy go zaabsorbować suchym piaskiem, suchą ziemią lub innym całkowicie suchym obojętnym absorbentem. SO3 Nie należy go wprowadzać do środowiska i nigdy nie dopuszczać do kontaktu z nim. Powinien być trzymany z dala od źródeł wody, ponieważ w ten sposób wytwarza kwas siarkowy, który jest szkodliwy dla organizmów wodnych i lądowych.
Bibliografia
- Sarkar, S. i in. (2019). Wpływ amoniaku i wody na losy trójtlenku siarki w troposferze: teoretyczne badanie szlaków tworzenia kwasu amoniowego i kwasu siarkowego. J Phys Chem A. 2019; 123 (14): 3131-3141. Odzyskany z ncbi.nlm.nih.gov.
- Muller, T.L. (2006). Kwas siarkowy i trójtlenek siarki. Kirk-Othmer Encyklopedia technologii chemicznej. Tom 23. Odzyskany z onlinelibrary.wiley.com.
- NAS. National Library of Medicine. (2019). Trójtlenek siarki. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Kikuchi, R. (2001). Zarządzanie środowiskowe emisją trójtlenku siarki: wpływ SO3 w sprawie zdrowia ludzi. Environmental Management (2001) 27: 837. Odzyskane z link.springer.com.
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Ismail, M.I. (1979). Ekstrakcja metali z siarczków przy użyciu trójtlenku siarki w złożu fluidalnym. J. Chem. Tech. Biotechnol. 1979, 29, 361-366. Odzyskany z onlinelibrary.wiley.com.



Jeszcze bez komentarzy