
Grupa metylowa lub metylowa
Plik grupa metylowa lub metylowa oznacza podstawnik alkilowy, którego wzór chemiczny to CH3. Jest to najprostszy ze wszystkich podstawników węglowych w chemii organicznej, ma jeden węgiel i trzy atomy wodoru; pochodzi z metanu. Ponieważ może wiązać się tylko z innym węglem, jego pozycja wskazuje na koniec łańcucha, jego zakończenie.
Na poniższym obrazku znajduje się jedna z wielu reprezentacji tej grupy. Krzywe po jego prawej stronie wskazują, że znajduje się za łączem H.3C- może oznaczać dowolny atom lub podstawnik; alkil, R, aromatyczny lub aryl, Ar lub heteroatom lub grupa funkcyjna, taka jak OH lub Cl.

Kiedy grupą funkcyjną dołączoną do metylu jest OH, mamy alkohol metanol, CH3O; a jeśli jest to Cl, będziemy mieli chlorek metylu, CH3Cl. W nomenklaturze organicznej określa się go po prostu jako „metyl” poprzedzony numerem jego pozycji w najdłuższym łańcuchu węglowym.
Grupa metylowa CH3 jest łatwy do zidentyfikowania podczas wyjaśniania struktur organicznych, zwłaszcza dzięki spektroskopii magnetycznego rezonansu jądrowego węgla 13 (C NMR13). Z niego, po silnych utlenieniach, otrzymuje się grupy kwasowe COOH, będące syntetyczną drogą syntezy kwasów karboksylowych.
Indeks artykułów
- 1 Reprezentacje
- 2 Struktura
- 3 Właściwości
- 4 Reaktywność
- 4.1 Utleniania
- 4.2 Jony
- 4.3 Reakcja metylacji
- 5 Referencje
Reprezentacje
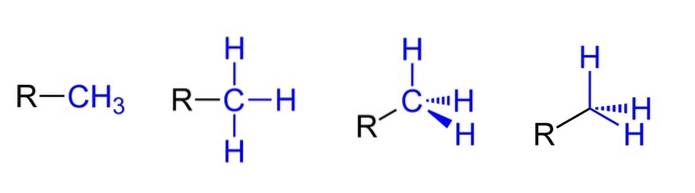
Powyżej mamy cztery możliwe reprezentacje przy założeniu, że CH3 jest połączony z podstawnikiem alkilowym R. Wszystkie są równoważne, ale przechodząc od lewej do prawej, przestrzenne aspekty cząsteczki są oczywiste.
Na przykład R-CH3 sprawia wrażenie płaskiego i liniowego. Poniższe przedstawienie przedstawia trzy wiązania kowalencyjne C-H, które pozwalają na identyfikację grupy metylowej w dowolnej strukturze Lewisa i dają fałszywe wrażenie krzyża..
Następnie, kontynuując w prawo (przedostatnia), obserwuje się hybrydyzację sp3 na węglu CH3 ze względu na jego czworościenną geometrię. W ostatnim przedstawieniu symbol chemiczny węgla nie jest nawet zapisany, ale czworościan jest zachowany, aby wskazać, które atomy H znajdują się przed lub za płaszczyzną..
Chociaż nie ma tego na zdjęciu, jest to kolejny bardzo powtarzający się sposób reprezentowania CH3 składa się z prostego umieszczenia łącznika (-) „nagi”. Jest to bardzo przydatne podczas rysowania dużych szkieletów węglowych..
Struktura

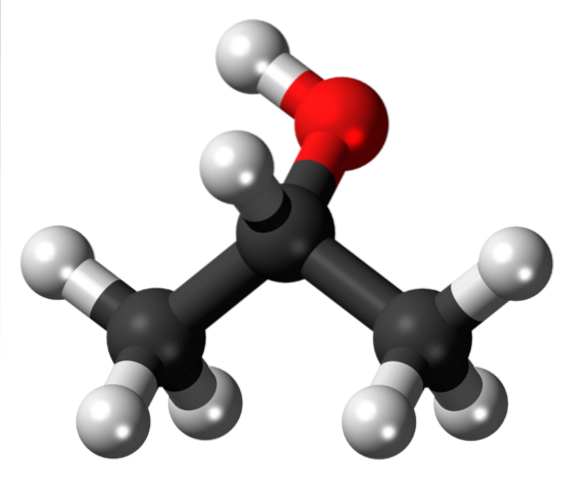
Górny obraz jest trójwymiarową reprezentacją pierwszego. Błyszcząca czarna kula odpowiada atomowi węgla, a biała atomom wodoru.
Ponownie, węgiel ma tetraedryczny produkt środowiskowy swojej hybrydyzacji sp3, i jako taka jest to stosunkowo obszerna grupa, z obrotami wiązań C-R z zawadą przestrzenną; to znaczy nie może się obracać, ponieważ białe kule zakłócałyby elektroniczne chmury sąsiednich atomów i odczuwałyby ich odpychanie.
Jednak wiązania C-H mogą wibrować, podobnie jak wiązanie C-R. Dlatego CH3 jest grupą geometrii tetraedrycznej, którą można wyjaśnić (określić, stwierdzić) za pomocą spektroskopii promieniowania podczerwonego (IR), podobnie jak wszystkie grupy funkcyjne i wiązania węglowe z heteroatomami.
Najważniejsze jest jednak jego wyjaśnienie metodą C-NMR.13. Dzięki tej technice określa się względną ilość grup metylowych, co pozwala na złożenie struktury molekularnej..
Generalnie więcej grup CH3 mają cząsteczkę, tym bardziej „niezgrabne” lub nieefektywne będą interakcje międzycząsteczkowe; to znaczy, im niższa będzie ich temperatura topnienia i wrzenia. Grupy CH3, ze względu na swoje atomy wodoru „ślizgają się” względem siebie, gdy się zbliżają lub dotykają.
Nieruchomości
Grupa metylowa charakteryzuje się tym, że jest zasadniczo hydrofobowa i niepolarna.
Dzieje się tak, ponieważ ich wiązania C-H nie są bardzo polarne z powodu małej różnicy między elektroujemnościami węgla i wodoru; Co więcej, jego tetraedryczna i symetryczna geometria rozkłada gęstości elektronów prawie jednorodnie, co przyczynia się do pomijalnego momentu dipolowego..
W przypadku braku polaryzacji CH3 „Ucieka” przed wodą, zachowując się jak hydrofob. Dlatego jeśli zostanie zauważony w cząsteczce, będzie wiadomo, że ten koniec metylowy nie będzie skutecznie oddziaływał z wodą lub innym polarnym rozpuszczalnikiem..
Kolejna cecha CH3 to jego względna stabilność. Dopóki atom, który jest z nim związany, nie usunie swojej gęstości elektronowej, pozostaje on praktycznie obojętny na bardzo silne media kwaśne. Jednak widać, że może uczestniczyć w reakcjach chemicznych, głównie w odniesieniu do jego utleniania lub migracji (metylacji) do innej cząsteczki..
Reaktywność
Utleniania
CH3 nie jest wolny od rdzewienia. Oznacza to, że jest podatny na tworzenie wiązań z tlenem C-O, jeśli reaguje z silnymi utleniaczami. W miarę utleniania przekształca się w różne grupy funkcyjne.
Na przykład podczas jego pierwszego utleniania powstaje grupa metiolowa (lub hydroksymetylowa) CHdwaOH, alkohol. Drugi pochodzi z grupy formylowej, CHO (HC = O), aldehydu. I wreszcie trzeci pozwala na jego przekształcenie w grupę karboksylową COOH, kwas karboksylowy.
Ta seria utleniania służy do syntezy kwasu benzoesowego (HOOC-C6H.5) z toluenu (H.3DC6H.5).
Jon
CH3 w mechanizmie niektórych reakcji może zyskiwać chwilowe ładunki elektryczne. Na przykład, gdy metanol jest ogrzewany w bardzo silnym środowisku kwaśnym, przy teoretycznym braku nukleofilów (poszukiwaczy ładunków dodatnich), kation metylu, CH3+, ponieważ wiązanie CH jest zerwane3-OH i OH wychodzą z parą elektronów wiązania.
Gatunek CH3+ jest tak reaktywny, że został określony dopiero w fazie gazowej, ponieważ reaguje lub znika przy najmniejszej obecności nukleofila.
Z drugiej strony CH3 można również otrzymać anion: metanowiec, CH3-, najprostszy karbanion ze wszystkich. Jednak podobnie jak ch3+, jego obecność jest nienormalna i występuje tylko w ekstremalnych warunkach.
Reakcja metylacji
W reakcji metylacji przenoszony jest CH3 do cząsteczki bez wytwarzania ładunków elektrycznych (CH3+ ani CH3-) w trakcie. Na przykład jodek metylu, CH3I, jest dobrym środkiem metylującym i może zastąpić wiązanie O-H kilku cząsteczek O-CH3.
W syntezie organicznej nie pociąga to za sobą żadnej tragedii; ale tak, kiedy to, co jest metylowane w nadmiarze, to zasady azotowe DNA.
Bibliografia
- Morrison, R. T. and Boyd, R, N. (1987). Chemia organiczna. Wydanie 5. Od redakcji Addison-Wesley Interamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Rahul Gladwin. (23 listopada 2018). Metylacja. Encyclopædia Britannica. Odzyskany z: britannica.com
- Danielle Reid. (2019). Grupa metylowa: struktura i formuła. Nauka. Odzyskany z: study.com
- Wikipedia. (2019). Grupa metylowa. Odzyskane z: en.wikipedia.org
Jeszcze bez komentarzy