
Model atomowy Heisenberga

Czym jest model atomowy Heisenberga?
Plik Model atomowy Heisenberga (1927) wprowadza zasadę nieoznaczoności do orbitali elektronów otaczających jądro atomowe. Wybitny niemiecki fizyk położył podwaliny pod mechanikę kwantową, aby oszacować zachowanie cząstek subatomowych tworzących atom.
Zasada nieoznaczoności Wernera Heisenberga wskazuje, że nie jest możliwe jednoczesne określenie położenia i pędu liniowego elektronu z całą pewnością. Ta sama zasada dotyczy zmiennych czasu i energii; to znaczy, jeśli mamy wskazówkę dotyczącą położenia elektronu, nie poznamy liniowego pędu elektronu i odwrotnie.
Krótko mówiąc, nie jest możliwe jednoczesne przewidywanie wartości obu zmiennych. Z powyższego nie wynika, że żadna z wyżej wymienionych wielkości nie może być dokładnie znana. Dopóki jest to oddzielnie, nie ma przeszkód w uzyskaniu wartości oprocentowania.
Jednak niepewność pojawia się, jeśli chodzi o jednoczesną znajomość dwóch sprzężonych wielkości, takich jak położenie i pęd liniowy oraz czas wraz z energią..
Zasada ta wynika ze ściśle teoretycznego rozumowania, jako jedynego sensownego wyjaśnienia uzasadniającego obserwacje naukowe.
Charakterystyka modelu atomowego Heisenberga

W marcu 1927 roku Heisenberg opublikował swoją pracę O percepcyjnej treści kinematyki i mechaniki teorii kwantowej, gdzie szczegółowo opisujesz zasadę nieoznaczoności lub nieokreśloności.
Zasada ta, fundamentalna w modelu atomowym zaproponowanym przez Heisenberga, charakteryzuje się następującymi cechami:
- Zasada nieoznaczoności pojawia się jako wyjaśnienie, które uzupełnia nowe teorie atomowe dotyczące zachowania elektronów. Pomimo stosowania przyrządów pomiarowych o wysokiej precyzji i czułości, nieokreśloność jest nadal obecna w każdym teście eksperymentalnym.
- Ze względu na zasadę nieoznaczoności, analizując dwie powiązane zmienne, jeśli masz dokładną wiedzę o jednej z nich, niepewność co do wartości drugiej zmiennej będzie coraz większa..
- Pędu i położenia elektronu lub innej subatomowej cząstki nie można zmierzyć w tym samym czasie.
- Związek między obiema zmiennymi jest określony przez nierówność. Według Heisenberga, iloczyn zmian pędu liniowego i położenia cząstki jest zawsze większy niż iloraz stałej Planka (6,62606957 (29) × 10 -3. 4 Jules x sekundy) i 4π, jak wyszczególniono w następującym wyrażeniu matematycznym:

Legenda odpowiadająca temu wyrażeniu jest następująca:
∆p: nieokreśloność momentu liniowego.
Δx: nieokreśloność pozycji.
h: stała deski.
π: liczba pi 3.14.
- W związku z powyższym iloczyn niepewności ma jako dolną granicę stosunek h / 4π, który jest wartością stałą. Dlatego jeśli jedna z wielkości zmierza do zera, druga musi wzrosnąć w tej samej proporcji.
- Zależność ta obowiązuje dla wszystkich par sprzężonych wielkości kanonicznych. Na przykład: Zasada nieoznaczoności Heisenberga doskonale nadaje się do pary energia-czas, jak opisano szczegółowo poniżej:
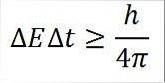
W tym wyrażeniu:
∆E: nieokreśloność energii.
∆t: nieokreśloność czasu.
h: stała deski.
π: liczba pi 3.14.
- Z tego modelu wynika, że absolutny determinizm przyczynowy w sprzężonych zmiennych kanonicznych jest niemożliwy, ponieważ do ustalenia tej zależności należy mieć wiedzę o początkowych wartościach badanych zmiennych..
- W konsekwencji model Heisenberga opiera się na sformułowaniach probabilistycznych, ze względu na losowość, która istnieje między zmiennymi na poziomach subatomowych..
Testy eksperymentalne
Zasada nieoznaczoności Heisenberga jawi się jako jedyne możliwe wyjaśnienie testów eksperymentalnych, które miały miejsce w pierwszych trzech dekadach XXI wieku..
Zanim Heisenberg ogłosił zasadę nieoznaczoności, obowiązujące wówczas przykazania sugerowały, że zmienne, między innymi, pęd liniowy, położenie, moment pędu, czas, energia dla cząstek subatomowych były definiowane operacyjnie..
Oznaczało to, że traktowano je tak, jakby były klasyczną fizyką; to znaczy, zmierzono wartość początkową i oszacowano wartość końcową zgodnie z wcześniej ustaloną procedurą.
Oznaczało to zdefiniowanie systemu odniesienia dla pomiarów, przyrządu pomiarowego i sposobu korzystania z tego instrumentu, zgodnie z metodą naukową..
W związku z tym zmienne opisane przez cząstki subatomowe musiały zachowywać się w sposób deterministyczny. Oznacza to, że jego zachowanie trzeba było przewidzieć dokładnie i precyzyjnie..
Jednak za każdym razem, gdy przeprowadzano badanie tego rodzaju, nie można było uzyskać w pomiarze teoretycznie oszacowanej wartości..
Pomiary były zniekształcone ze względu na naturalne warunki eksperymentu, a uzyskany wynik nie był przydatny do wzbogacenia teorii atomowej.
Przykład
Na przykład: jeśli chodzi o pomiar prędkości i położenia elektronu, konfiguracja eksperymentu musi uwzględniać zderzenie fotonu światła z elektronem.
Zderzenie to wywołuje zmianę prędkości i wewnętrznego położenia elektronu, z którym obiekt pomiaru jest zmieniany przez warunki eksperymentalne..
Dlatego badacz zachęca do wystąpienia nieuniknionego błędu eksperymentalnego, pomimo dokładności i precyzji zastosowanych instrumentów..
Mechanika kwantowa inna niż mechanika klasyczna
Oprócz powyższego zasada nieokreśloności Heisenberga stwierdza, że z definicji mechanika kwantowa działa inaczej niż mechanika klasyczna.
W związku z tym przyjmuje się, że dokładną wiedzę o pomiarach na poziomie subatomowym ogranicza cienka linia oddzielająca mechanikę klasyczną od kwantowej..
Ograniczenia modelu Heisenberga
Pomimo wyjaśnienia nieokreśloności cząstek subatomowych i ustalenia różnic między mechaniką klasyczną i kwantową, model atomowy Heisenberga nie ustanawia ani jednego równania, które wyjaśniałoby losowość tego typu zjawisk..
Co więcej, fakt, że związek jest ustanawiany przez nierówność, oznacza, że zakres możliwości iloczynu dwóch sprzężonych zmiennych kanonicznych jest nieokreślony. W konsekwencji niepewność związana z procesami subatomowymi jest znaczna..
Ciekawe artykuły
Model atomowy Schrödingera.
Model Atomic de Broglie.
Model atomowy Chadwicka.
Model atomowy Perrina.
Model atomowy Thomsona.
Model atomowy Daltona.
Model atomowy Diraca Jordana.
Atomowy model Demokryta.
Model atomowy Leucippus.
Model atomowy Bohra.
Model atomowy Sommerfelda.
Aktualny model atomowy.
Bibliografia
- Beyler, R. (1998). Werner Heisenberg. Encyclopædia Britannica, Inc. Źródło: britannica.com
- Zasada nieoznaczoności Heisenberga (patrz dalej). Odzyskany z: hiru.eus
- García, J. (2012). Zasada nieoznaczoności Heisenberga. Odzyskany z: hiberus.com
- Modele atomowe (s.f.). Narodowy Autonomiczny Uniwersytet Meksyku. Mexico DF, Meksyk. Odzyskany z: asesorias.cuautitlan2.unam.mx
- Werner Heisenberg (s.f.). Pobrane z: the-history-of-the-atom.wikispaces.com
- Wikipedia, wolna encyklopedia (2018). Deska jest stała. Odzyskane z: es.wikipedia.org
- Wikipedia, wolna encyklopedia (2018). Relacja nieokreśloności Heisenberga. Odzyskane z: es.wikipedia.org

Jeszcze bez komentarzy