
Kroki metody równoważenia redox, przykłady, ćwiczenia
Plik metoda równoważenia redoks To ten, który pozwala zbilansować równania chemiczne reakcji redoks, które w przeciwnym razie byłyby bólem głowy. Tutaj jeden lub więcej gatunków wymienia elektrony; ten, który je przekazuje lub traci, nazywany jest gatunkiem utleniającym, a ten, który je przyjmuje lub pozyskuje, gatunkiem redukującym.
W tej metodzie niezbędna jest znajomość stopni utlenienia tych gatunków, ponieważ ujawniają one, ile elektronów zyskały lub utraciły na mol. Dzięki temu możliwe jest zbilansowanie ładunków elektrycznych poprzez zapisanie elektronów w równaniach tak, jakby były reagentami lub produktami..
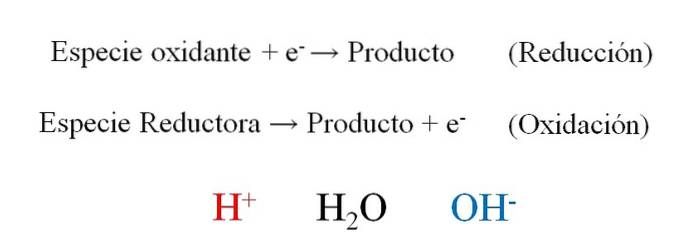
Powyższy obrazek pokazuje, jak skutecznie elektrony i- są umieszczane jako reagenty, gdy pozyskuje je utleniacz; i jako produkty, gdy gatunek redukujący je traci. Należy zauważyć, że aby zrównoważyć tego typu równania, konieczne jest opanowanie pojęć liczb utleniania i utleniania-redukcji..
Gatunek H.+, H.dwaO i OH-, W zależności od pH środowiska reakcyjnego pozwala na równoważenie redoks, dlatego bardzo często można je znaleźć w ćwiczeniach. Jeśli medium jest kwaśne, zwracamy się do H.+; ale jeśli wręcz przeciwnie, medium jest podstawowe, używamy OH- do bujania.
Charakter samej reakcji decyduje o pH środowiska. Dlatego, chociaż można je zbilansować zakładając kwaśne lub zasadowe środowisko, ostateczne zbilansowane równanie wskaże, czy jony H są naprawdę zbędne, czy nie.+ i OH-.
Indeks artykułów
- 1 kroki
- 1.1 - Ogólne
- 1.2 - Równoważenie w środowisku kwaśnym
- 1.3 - Równoważenie w podstawowym medium
- 2 Przykłady
- 3 Ćwiczenia
- 3.1 Ćwiczenie 1
- 3.2 Ćwiczenie 2
- 4 Odnośniki
Kroki
- Generał
Sprawdź stopień utlenienia reagentów i produktów
Załóżmy następujące równanie chemiczne:
Cu (s) + AgNO3(ac) → Cu (NO3)dwa + Ag (y)
Odpowiada to reakcji redoks, w której następuje zmiana stopnia utlenienia reagentów:
Cu0(s) + Ag+NIE3(ac) → Cudwa+(NIE3)dwa + Ag (y)0
Zidentyfikuj związki utleniające i redukujące
Forma utleniająca zyskuje elektrony przez utlenianie formy redukującej. Dlatego jego stopień utlenienia spada: staje się mniej dodatni. W międzyczasie stopień utlenienia związków redukujących wzrasta, ponieważ traci on elektrony: staje się bardziej dodatni..
Tak więc w poprzedniej reakcji miedź jest utleniana, ponieważ przechodzi z Cu0 do Cudwa+; a srebro jest redukowane, ponieważ przechodzi z Ag+ do Ag0. Miedź jest związkiem redukującym, a srebro utleniaczem.
Napisz reakcje połówkowe i zrównoważyć atomy i ładunki
Identyfikując, które gatunki uzyskują lub tracą elektrony, półreakcje redoks są zapisywane zarówno dla reakcji redukcji, jak i utleniania:
Cu0 → Cudwa+
Ag+ → Ag0
Miedź traci dwa elektrony, a srebro zyskuje jeden. Umieszczamy elektrony w obu półreakcjach:
Cu0 → Cudwa+ + 2e-
Ag+ + i- → Ag0
Należy zauważyć, że obciążenia pozostają zrównoważone w obu reakcjach połowicznych; ale gdyby je zsumować, naruszałoby się prawo zachowania materii: liczba elektronów musi być równa w obu reakcjach połowicznych. Dlatego drugie równanie mnoży się przez 2 i dodaje się dwa równania:
(Cu0 → Cudwa+ + 2e-) x 1
(Ag+ + i- → Ag0) x 2
Cu0 + 2Ag+ + 2e- → Cudwa+ + 2Ag0 + 2e-
Elektrony znoszą się, ponieważ znajdują się po bokach reagentów i produktów:
Cu0 + 2Ag+ → Cudwa+ + 2Ag0
To jest globalne równanie jonowe.
Zastąp współczynniki z równania jonowego do równania ogólnego
Na koniec współczynniki stechiometryczne z poprzedniego równania są przenoszone do pierwszego równania:
Cu (s) + 2Ag NO3(ac) → Cu (NO3)dwa + 2 ag (y)
Zauważ, że 2 zostało ustawione z AgNO3 ponieważ w tej soli srebro jest jak Ag+, i to samo dzieje się z Cu (NIE3)dwa. Jeśli na końcu to równanie nie jest zbilansowane, przystępujemy do przeprowadzenia próby.
Równanie zaproponowane w poprzednich krokach można było zrównoważyć bezpośrednio metodą prób i błędów. Istnieją jednak reakcje redoks, które wymagają środowiska kwaśnego (H.+) lub podstawowy (OH-). Kiedy tak się dzieje, nie można tego wyważyć, zakładając, że medium jest neutralne; jak właśnie pokazano (nie H+ i ani OH-).
Z drugiej strony wygodnie jest wiedzieć, że atomy, jony lub związki (głównie tlenki), w których zachodzą zmiany stopni utlenienia, są zapisywane w reakcjach połowicznych. Zostanie to zaznaczone w sekcji ćwiczeń.
- Równowaga w środowisku kwaśnym
Gdy medium jest kwaśne, konieczne jest zatrzymanie się na dwóch półreakcjach. Tym razem podczas równoważenia ignorujemy atomy tlenu i wodoru, a także elektrony. Elektrony w końcu się zbilansują.
Następnie po stronie reakcji z mniejszą liczbą atomów tlenu dodajemy cząsteczki wody, aby ją uzupełnić. Z drugiej strony równoważymy wodory jonami H.+. Na koniec dodajemy elektrony i postępujemy zgodnie z ogólnymi krokami już przedstawionymi..
- Równowaga w podstawowym medium
Gdy ośrodek jest zasadowy, postępuje się tak samo jak w środowisku kwaśnym z niewielką różnicą: tym razem po stronie, gdzie jest więcej tlenu, będzie zlokalizowana liczba cząsteczek wody równa temu nadmiarowi tlenu; a z drugiej strony jony OH- kompensować wodory.
Wreszcie, elektrony są zrównoważone, dwie reakcje połówkowe są dodawane, a współczynniki globalnego równania jonowego są podstawiane w równaniu ogólnym.
Przykłady
Poniższe zrównoważone i niezrównoważone równania redoks służą jako przykłady, aby zobaczyć, jak bardzo zmieniają się po zastosowaniu tej metody równoważenia:
P.4 + ClO- → PO43- + Cl- (niezrównoważony)
P.4 + 10 ClO- + 6 godzdwaO → 4 PO43- + 10 Cl- + 12 godz+ (zrównoważone środowisko kwaśne)
P.4 + 10 ClO- + 12 OH- → 4 PO43- + 10 Cl- + 6 godzdwaO (zrównoważony średni podstawowy)
jadwa + KNO3 → Ja- + KIO3 + NIE3- (niezrównoważony)
3Idwa + KNO3 + 3HdwaO → 5 I.- + KIO3 + NIE3- + 6H+ (zrównoważone środowisko kwaśne)
CrdwaLUBdwa7- + HNOdwa → Cr3+ + NIE3- (niezrównoważony)
3HNOdwa + 5H+ + CrdwaLUBdwa7- → 3NO3- +2Cr3+ + 4HdwaO (zrównoważone medium kwaśne)
Trening
Ćwiczenie 1
Zrównoważyć następujące równanie w podstawowym medium:
jadwa + KNO3 → Ja- + KIO3 + NIE3-
Ogólne kroki
Rozpoczynamy od zapisania wartości utlenienia gatunków, które, jak podejrzewamy, zostały utlenione lub zredukowane; w tym przypadku atomy jodu:
jadwa0 + KNO3 → Ja- + KI5+LUB3 + NIE3-
Zauważ, że jod jest utleniany i jednocześnie redukowany, więc przystępujemy do zapisywania ich dwóch odpowiednich półreakcji:
jadwa → Ja- (redukcja, dla każdego I- Zużywa się 1 elektron)
jadwa → IO3- (utlenianie, dla każdego IO3- 5 elektronów zostaje uwolnionych)
W półreakcji utleniania umieszczamy anion IO3-, a nie atom jodu jak ja5+. Równoważymy atomy jodu:
jadwa → 2 I.-
jadwa → 2IO3-
Równowaga w podstawowym medium
Teraz skupiamy się na równoważeniu półreakcji utleniania w podstawowym ośrodku, ponieważ zawiera on formy utlenione. Po stronie produktu dodajemy taką samą liczbę cząsteczek wody, ile jest atomów tlenu:
jadwa → 2IO3- + 6HdwaLUB
A po lewej stronie równoważymy wodory z OH-:
jadwa + 12OH- → 2IO3- + 6HdwaLUB
Zapisujemy dwie reakcje połowiczne i dodajemy brakujące elektrony, aby zrównoważyć ładunki ujemne:
jadwa + 2e- → 2 I.-
jadwa + 12OH- → 2IO3- + 6HdwaO + 10e-
Wyrównujemy liczby elektronów w obu reakcjach połowicznych i dodajemy je:
(JAdwa + 2e- → 2 I.-) x 10
(JAdwa + 12OH- → 2IO3- + 6HdwaO + 10e-) x 2
12Idwa + 24 OH- + 20e- → 20 I.- + 4IO3- + 12HdwaO + 20e-
Elektrony znoszą się i dzielimy wszystkie współczynniki przez cztery, aby uprościć globalne równanie jonowe:
(12Idwa + 24 OH- → 20 I.- + 4IO3- + 12HdwaO) x ¼
3Idwa + 6OH- → 5 I.- + IO3- + 3HdwaLUB
Na koniec podstawiamy współczynniki równania jonowego w pierwszym równaniu:
3Idwa + 6OH- + KNO3 → 5 I.- + KIO3 + NIE3- + 3HdwaLUB
Równanie jest już zbilansowane. Porównaj ten wynik z bilansowaniem w środowisku kwaśnym z przykładu 2.
Ćwiczenie 2
Zrównoważyć następujące równanie w środowisku kwaśnym:
WiaradwaLUB3 + CO → Fe + COdwa
Ogólne kroki
Patrzymy na stopnie utlenienia żelaza i węgla, aby dowiedzieć się, który z nich został utleniony lub zredukowany:
Wiaradwa3+LUB3 + dodwa+O → Wiara0 + do4+LUBdwa
Żelazo zostało zredukowane, czyniąc go związkiem utleniającym. W międzyczasie węgiel został utleniony, zachowując się jak substancja redukująca. Rozpatrywane półreakcje utleniania i redukcji to:
Wiaradwa3+LUB3 → Wiara0 (redukcja, dla każdego Fe pobierane są 3 elektrony)
CO → COdwa (utlenianie, dla każdego COdwa 2 elektrony są uwalniane)
Zauważ, że piszemy tlenek FedwaLUB3, ponieważ zawiera wiarę3+, zamiast po prostu umieszczać Fe3+. Równoważymy potrzebne atomy z wyjątkiem tlenu:
WiaradwaLUB3 → 2Fe
CO → COdwa
I przystępujemy do równoważenia w środowisku kwaśnym w obu reakcjach połowicznych, ponieważ pomiędzy nimi znajdują się związki utlenione..
Równowaga w środowisku kwaśnym
Dodajemy wodę, aby zrównoważyć tlen, a następnie H.+ aby zrównoważyć wodory:
WiaradwaLUB3 → 2Fe + 3HdwaLUB
6H+ + WiaradwaLUB3 → 2Fe + 3HdwaLUB
CO + HdwaO → COdwa
CO + HdwaO → COdwa + 2H+
Teraz równoważymy ładunki, umieszczając elektrony biorące udział w reakcjach połowicznych:
6H+ + 6e- + WiaradwaLUB3 → 2Fe + 3HdwaLUB
CO + HdwaO → COdwa + 2H+ + 2e-
Wyrównujemy liczbę elektronów w obu półreakcjach i dodajemy je:
(6 godz+ + 6e- + WiaradwaLUB3 → 2Fe + 3HdwaO) x 2
(CO + HdwaO → COdwa + 2H+ + 2e-) x 6
12 godz+ + 12e- + 2FedwaLUB3 + 6CO + 6HdwaO → 4Fe + 6HdwaO + 6COdwa + 12H+ + 12e-
Eliminujemy elektrony, jony H.+ i cząsteczki wody:
2FedwaLUB3 + 6CO → 4Fe + 6COdwa
Ale te współczynniki można podzielić przez dwa, aby jeszcze bardziej uprościć równanie, mając:
WiaradwaLUB3 + 3CO → 2Fe + 3COdwa
Powstaje pytanie: czy równoważenie redoks było konieczne dla tego równania? Metoda prób i błędów byłaby znacznie szybsza. To pokazuje, że ta reakcja przebiega niezależnie od pH środowiska..
Bibliografia
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Helmenstine, dr Anne Marie (22 września 2019). Jak zrównoważyć reakcje redoks. Odzyskany z: thinkco.com
- Ann Nguyen i Luvleen Brar. (05 czerwca 2019). Równoważenie reakcji redoks. Chemia LibreTexts. Źródło: chem.libretexts.org
- Quimitube. (2012). Ćwiczenie 19: Regulacja reakcji redoks w środowisku podstawowym z dwoma półreakcjami utleniania. Odzyskany z: quimitube.com
- Washington University w St. Louis. (s.f.). Problemy praktyczne: reakcje redoks. Odzyskany z: chemistry.wustl.edu
- John Wiley & Sons. (2020). Jak zrównoważyć równania redoks. Odzyskany z: dummies.com
- Rubén Darío O. G. (2015). Bilansowanie równań chemicznych. Odzyskany z: aprendeenlinea.udea.edu.co



Jeszcze bez komentarzy