
Struktura, właściwości, zastosowania, zagrożenia azotanem sodu (NaNO3)

Plik Azotan sodu jest krystaliczną nieorganiczną substancją stałą utworzoną przez jon sodu Na+ i jon azotanowy NO3-. Jego wzór chemiczny to NaNO3. W naturze występuje jako minerał nitratyny lub azotatytu, który występuje w dużych ilościach na pustyni Atacama w Chile, dlatego ten minerał jest również nazywany chilijską saletrą lub kaliszą..
Azotan sodu jest niepalnym ciałem stałym, ale może przyspieszyć utlenianie lub spalanie materiałów łatwopalnych. Z tego powodu jest szeroko stosowany w fajerwerkach, materiałach wybuchowych, zapałkach, cegłach węglowych i niektórych rodzajach pestycydów do zabijania gryzoni i innych małych ssaków..

Zdolność do wspomagania spalania lub zapłonu innych materiałów oznacza, że należy obchodzić się z nim z dużą ostrożnością. W przypadku wystawienia na działanie ognia lub ognia może wybuchnąć. Mimo to NaNO3 Znajduje zastosowanie w przemyśle spożywczym, ponieważ ma właściwości konserwujące, szczególnie do mięs i niektórych rodzajów serów..
Jednak jego nadmierne spożycie może powodować problemy zdrowotne, zwłaszcza u kobiet w ciąży, niemowląt i dzieci. Przekształcając się w azotyny w układzie pokarmowym, może powodować pewne choroby.
Indeks artykułów
- 1 Struktura chemiczna
- 2 Nazewnictwo
- 3 Właściwości
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Temperatura wrzenia
- 3.5 Gęstość
- 3.6 Rozpuszczalność
- 3,7 pH
- 3.8 Inne właściwości
- 4 Otrzymywanie
- 4.1 Obecność w ludzkim ciele
- 5 zastosowań
- 5.1 W przemyśle spożywczym
- 5.2 W nawozach
- 5.3 Jako promotor lub ułatwiający spalanie lub wybuch
- 5.4 Eliminacja gryzoni i innych ssaków
- 5.5 W przygotowaniu innych związków
- 5.6 Przy wydobywaniu metali z odpadów elektronicznych
- 5.7 W badaniach nad zdrowiem i ćwiczeniami fizycznymi
- 5.8 Do różnych zastosowań
- 6 Ryzyka
- 6.1 Niebezpieczeństwa związane z obsługą
- 6.2 Problemy związane z jego spożyciem z jedzeniem lub wodą
- 7 Azotan sodu w żywności
- 8 Odniesienia
Struktura chemiczna
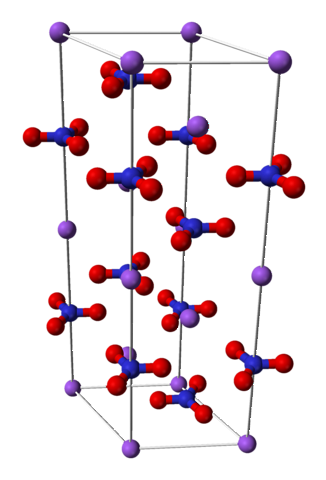
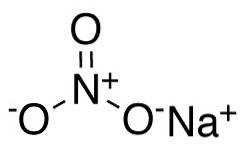
Azotan sodu składa się z kationu sodu Na+ i anion azotanowy NO3-.
W anionie azotanowym NO3- azot N ma wartościowość +5, a tlen ma wartościowość -2. Z tego powodu anion azotanowy ma ładunek ujemny..
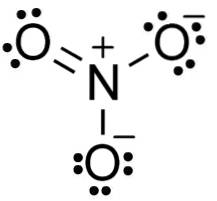
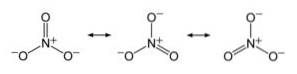
Anion NIE3- ma płaską i symetryczną strukturę, w której trzy tlenki równomiernie lub równomiernie rozprowadzają ładunek ujemny.
Nomenklatura
-Azotan sodu
-Azotan sodu
-Saletra sodowa (z angielskiego saletra sodowa)
-Soda nitro (z angielskiego azotan sodu)
-Saletra z Chile
-Azotany z Chile
-Nitratyna
-Nitratyt
-Caliche
Nieruchomości

Stan fizyczny
Kryształy bezbarwne do białego, trygonalne lub romboedryczne.
Waga molekularna
84,995 g / mol
Temperatura topnienia
308 ºC
Temperatura wrzenia
380 ºC (rozkłada się).
Gęstość
2257 g / cm3 przy 20 ºC.
Rozpuszczalność
Rozpuszczalny w wodzie: 91,2 g / 100 g wody o temperaturze 25 ° C lub 1 gw 1,1 ml wody. Słabo rozpuszczalny w etanolu i metanolu.
pH
Roztwory azotanu sodu są obojętne, to znaczy ani kwaśne, ani zasadowe, dlatego ich pH wynosi 7.
Inne właściwości
Jest higroskopijnym ciałem stałym, czyli pochłania wodę z otoczenia.

Jego rozpuszczenie w wodzie powoduje ochłodzenie roztworu, dlatego mówi się, że ten proces rozpuszczania jest endotermiczny, innymi słowy, gdy się rozpuszcza, pochłania ciepło z otoczenia i dlatego roztwór chłodzi się.
W bardzo niskich temperaturach azotan sodu jest rozpuszczalny w ciekłym amoniaku NH3, tworząc NaNO34NH3 poniżej -42 ºC.
Nano3 Nie jest palny, ale jego obecność przyspiesza spalanie materiałów lub związków, które są. Dzieje się tak, ponieważ po podgrzaniu wytwarza tlen O.dwa, wśród innych gazów.
Otrzymywanie
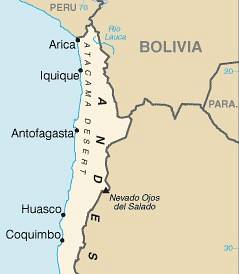
Uzyskuje się go głównie poprzez wydobycie ze złóż mineralnych lub kopalń saletry w Chile (kalisz lub azotatyt). W tym celu stosuje się solankę, a następnie przeprowadza się krystalizację i rekrystalizację w celu uzyskania kryształów NaNO.3 bardziej czysty.
Te kopalnie znajdują się głównie w Ameryce Południowej na północy Chile na pustyni Atakama. Tam jest związany z azotanem potasu KNO3 i rozkładającej się materii organicznej.
Można go również otrzymać w reakcji kwasu azotowego z węglanem sodu NadwaWSPÓŁ3 lub z wodorotlenkiem sodu NaOH:
2 HNO3 + NadwaWSPÓŁ3 → 2 NaNO3 + WSPÓŁdwa↑ + HdwaLUB
Obecność w organizmie człowieka
Azotan sodu może przedostawać się do organizmu człowieka wraz z zawartą w nim żywnością i wodą pitną..
60-80% spożywanych azotanów pochodzi z owoców i warzyw. Drugim źródłem są wędliny. Jest stosowany w przemyśle mięsnym w celu zapobiegania rozwojowi drobnoustrojów i zachowania koloru.
Jednak duża część azotanów obecnych w organizmie człowieka pochodzi z jego endogennej syntezy lub z procesów zachodzących w organizmie..
Aplikacje
W przemyśle spożywczym
Jest stosowany jako konserwant w żywności, jako środek peklujący do marynowanych mięs oraz jako środek utrwalający kolor do mięs. Pokarmy, które mogą go zawierać, to bekon, kiełbaski, szynka i niektóre sery.

W nawozach
Azotan sodu jest stosowany w mieszankach nawozowych do nawożenia tytoniu, bawełny i roślin warzywnych.

Jako promotor lub promotor spalania lub wybuchu
Nano3 jest używany jako utleniacz w wielu zastosowaniach. Jest to ciało stałe bogate w tlen, które ułatwia proces zapłonu poprzez wytwarzanie O.dwa.
Obecność NaNO3 sprawia, że materiały nie wymagają tlenu ze źródeł zewnętrznych do zapłonu, ponieważ dostarcza wystarczającej ilości O.dwa co do samopodtrzymujących się reakcji egzotermicznych (generujących ciepło), które zachodzą podczas zapłonu lub wybuchu.
Od dawna jest stosowany jako główny utleniacz w materiałach pirotechnicznych (fajerwerkach), jako składnik utleniający w materiałach wybuchowych i detonacyjnych lub wybuchowych oraz jako propelent.

Służy również do polepszenia spalania cegieł węglowych (brykietów), do sprzyjania zapaleniu zapałek, a nawet do polepszenia właściwości palnych tytoniu..
Aby wyeliminować gryzonie i inne ssaki
Służy do specjalnego rodzaju pestycydów. Kompozycje, które go zawierają, to pirotechniczne fumiganty, które są umieszczane i podpalane w norach, uwalniając śmiertelne dawki toksycznych gazów.
Z tego powodu jest stosowany do zwalczania różnych gryzoni, świstaków, kojotów i skunksów na otwartych polach, łąkach, obszarach nieuprawianych, trawnikach i polach golfowych..
W przygotowaniu innych związków
Używany do produkcji kwasu azotowego HNO3, azotyn sodu NaNOdwa, a także działa jako katalizator przy wytwarzaniu kwasu siarkowego Hdwapołudniowy zachód4.
Jest używany do produkcji podtlenku azotu NdwaLub i jako środek utleniający w produkcji związków farmaceutycznych.
W wydobyciu metali z e-odpadów
Niektórzy badacze odkryli, że NaNO3 ułatwia nieszkodliwe wydobycie metali zawartych w odpadach sprzętu elektronicznego (telefony komórkowe, tablety, komputery itp.).
Użyteczne metale, które można wyekstrahować ze składników tego sprzętu elektronicznego, to nikiel Ni, kobalt Co, mangan Mn, cynk Zn, miedź Cu i aluminium Al..
Ekstrakcja jest przeprowadzana wyłącznie przy użyciu roztworu NaNO3 i polimer. Osiąga się wydajność 60%.
W ten sposób odpady elektroniczne można poddać recyklingowi, przyczyniając się do minimalizacji ilości odpadów i stabilnego odzyskiwania zasobów..
W badaniach nad zdrowiem i ćwiczeniami fizycznymi
Według niektórych badań spożycie suplementów NaNO3 lub żywność, która go zawiera, ma pozytywny wpływ na zdrowie. Niektóre produkty bogate w azotany to buraki, szpinak i rukola.
Efekty obejmują poprawę układu sercowo-naczyniowego, obniżenie ciśnienia krwi, poprawę przepływu krwi i zwiększenie ilości tlenu w tkankach ćwiczących fizycznie..
Wskazuje to, że można rozważyć użycie NaNO.3 jako niedrogi lek stosowany w profilaktyce i leczeniu pacjentów z problemami z ciśnieniem krwi.
Ponadto może służyć jako skuteczna i naturalna pomoc w zwiększaniu siły mięśni u sportowców.
W różnych zastosowaniach

Stosowany jest jako utleniacz i topnik w produkcji szkliw szklanych i ceramicznych. Jest również stosowany w specjalnych cementach.
Służy jako środek chemiczny do odzyskiwania cyny ze złomu, w koagulacji lateksowej, w przemyśle nuklearnym oraz w kontroli korozji w układach wodnych.
Ryzyka
Niebezpieczeństwa związane z obsługą
Ma właściwość przyspieszania spalania materiałów łatwopalnych. Jeśli bierzesz udział w pożarze, może dojść do wybuchu.
Pod wpływem ciepła lub ognia przez dłuższy czas może eksplodować, wytwarzając toksyczne tlenki azotu..
Problemy związane z jego spożyciem z jedzeniem lub wodą
Azotany po spożyciu mogą stać się azotynami zarówno w jamie ustnej, jak iw żołądku i jelitach..
Azotyny, reagując z aminami obecnymi w niektórych produktach spożywczych, mogą stać się nitrozoaminami w środowisku kwaśnym, takim jak żołądek. Nitrozoaminy są rakotwórcze.
Jednak tak się nie dzieje, gdy owoce i warzywa zawierające azotany są spożywane w sposób naturalny..
Według niektórych badań obecność wysokiego poziomu azotanów może powodować zaburzenia krwi, które uniemożliwiają skuteczne uwalnianie tlenu w tkankach.
Może się to zdarzyć u niemowląt, których mleko modyfikowane jest wytwarzane z wody ze studni zawierającej azotany..
Zaobserwowano również, że wysoki poziom azotanów może powodować problemy w ciąży u niemowląt, powodując samoistne poronienia, przedwczesne porody lub wady cewy nerwowej płodu..
Niedawno odkryto, że azotan sodu może stanowić zagrożenie dla rozwoju układu mięśniowo-szkieletowego i zaburza komunikację nerwowo-mięśniową u ludzi..
Azotan sodu w żywności

Azotan sodu jest synonimem mięs, ponieważ wraz z azotynami dodaje się je do nich w celu ich utrwalenia oraz poprawy ich wyglądu i smaku. Z tego powodu nadmierne spożycie mięsa (hot dogi, bekonu, szynek, wędzonych ryb itp.) Jest przyczyną niepokojącego połączenia nowotworów w całym układzie pokarmowym..
Chociaż związek między mięsem leczonym solami azotanowo-azotynowymi a rakiem nie jest bezwzględny, zaleca się umiarkowane spożycie.
Z drugiej strony warzywa (marchew, buraki, rzodkiewka, sałata, szpinak itp.) Są bogate w NaNO3 ponieważ wchłonęli go z gleb uprawnych dzięki działaniu nawozowemu. Spożycie tych warzyw, w przeciwieństwie do produktów mięsnych, nie ma związku z wyżej wymienionymi chorobami.
Wynika to z dwóch powodów: różnicy w poziomie białka w takich pokarmach oraz sposobu ich przyrządzania. Kiedy mięso jest smażone lub podgrzewane do płomienia, reakcja między azotanami-azotynami z pewnymi grupami aminokwasów jest promowana, w wyniku czego powstają nitrozoaminy: prawdziwe czynniki rakotwórcze.
Zawartość witaminy C, błonnika i polifenoli w warzywach ogranicza powstawanie tych nitrozoamin. Właśnie dlatego NaNO3 sam nie stanowi zagrożenia dla żywności.
Bibliografia
- NAS. National Library of Medicine. (2019). Azotan sodu. Odzyskany z: pubchem.ncbi.nlm.nih.gov.
- Encyklopedia chemii przemysłowej Ullmanna. (1990). Piąta edycja. VCH Verlagsgesellschaft mbH.
- Pouretedal, H.R. i Ravanbod, M. (2015). Badanie kinetyczne Mg / NaNO3 pirotechniczne wykorzystujące nieizotermiczną technikę TG / DSC. J Therm Anal Calorim (2015) 119: 2281–2288. Odzyskany z link.springer.com.
- Jarosz, J. i in. (2016). Azotan sodu zmniejsza skupianie się receptorów acetylocholiny indukowanych agryną. BMC Pharmacology and Toxicology (2016) 17:20. Odzyskany z bmcpharmacoltoxicol.biomedcentral.com.
- Cotton, F. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Prival, M.J. (2003). Rak. Czynniki rakotwórcze w łańcuchu pokarmowym. W Encyklopedii Nauk o Żywności i Żywieniu (drugie wydanie). Odzyskany z sciencedirect.com.
- Zakhodyaeva, Y.A. et al. (2019). Kompleksowa ekstrakcja metali w wodnym systemie dwufazowym na bazie poli (tlenku etylenu) 1500 i azotanu sodu. Molecules 2019, 24, 4078. Odzyskane z mdpi.com.
- Clements, W.T. et al. (2014). Spożycie azotanów: przegląd wpływu na zdrowie i sprawność fizyczną. Składniki odżywcze 2014, 6, 5224-5264. Odzyskany z mdpi.com.



Jeszcze bez komentarzy