
Do czego służy układ okresowy? 7 ważnych zastosowań

Plik okresowy Służy do pokazania relacji między różnymi elementami; Można go również wykorzystać do przewidywania właściwości nowych pierwiastków, które zostały jeszcze odkryte lub jeszcze nie zsyntetyzowane..
Dostarcza informacji i danych o grupach, pierwiastkach, masie atomowej, energii jonizacji, konfiguracji elektronowej, liczbie atomowej, elektroujemności i stanach utlenienia. Układ okresowy zapewnia również przydatne ramy do analizy zachowania chemicznego; Jest szeroko stosowany w chemii i wielu innych naukach.
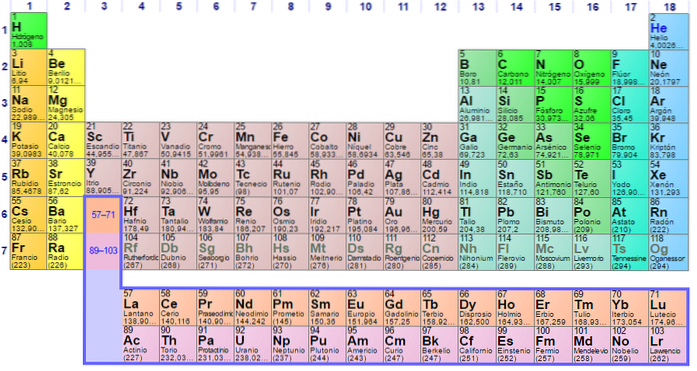
Został zbudowany w 1869 roku przez rosyjskiego naukowca Dmitrija Iwanowicza Mendelejewa, aby zwizualizować różne relacje między różnymi pierwiastkami chemicznymi.
Układ okresowy jest uporządkowany według liczby atomowej, konfiguracji elektronów i powtarzających się właściwości chemicznych. Jest również uporządkowany tak, aby elementy o podobnych zachowaniach znajdowały się w tej samej kolumnie.
Stół składa się z czterech prostokątnych bloków o podobnych właściwościach chemicznych. Generalnie elementy znajdujące się po lewej stronie rzędu to metale, a niemetale po prawej stronie.
Pierwiastki są rozmieszczone w układzie okresowym na podstawie ich struktury atomowej. Każdy wiersz i każda kolumna mają specjalne cechy.
Wszystkie wiersze w tabeli są odczytywane od lewej do prawej, a każdy wiersz jest nazywany kropką. Każda kolumna w tabeli nazywana jest grupą. Każda grupa w tabeli ma taką samą liczbę elektronów.
Łatwo jest znaleźć liczbę elektronów w zewnętrznej powłoce każdego elementu w tabeli. Grupa pierwsza ma jeden elektron, grupa druga dwa i tak dalej.
Dobry układ okresowy jest doskonałym narzędziem do rozwiązywania problemów w chemii. Tabele okresowe można znaleźć w Internecie lub wydrukować.
Używa układu okresowego pierwiastków, do czego to służy?
Poznaj symbol pierwiastka chemicznego
Symbole są skrótem nazwy elementu. W wielu przypadkach skrót pochodzi od oryginalnej łacińskiej nazwy.
Każdy symbol ma jedną lub dwie litery jako skrót. Zwykle symbol jest skrótem nazwy elementu, ale niektóre symbole odnoszą się do starych nazw elementów.
Przykładem tego przypadku jest srebro; jego symbolem jest Ag, co nawiązuje do jego starej nazwy, która była argentum.
Znać liczbę atomową pierwiastka
To jest liczba protonów, które zawiera atom tego pierwiastka. Liczba protonów jest decydującym czynnikiem, jeśli chodzi o odróżnienie jednego pierwiastka od drugiego. Zmiana liczby elektronów lub neutronów nie zmienia rodzaju pierwiastka.
Zmieniająca się liczba elektronów wytwarza jony, a zmiany liczby neutronów - izotopy. Współczesny układ okresowy jest ułożony rosnąco według liczby atomowej.
Zidentyfikuj, co oznaczają okresy i grupy układu okresowego
Poziome rzędy nazywane są kropkami. Każdy okres wskazuje najwyższy poziom energii, jaką każdy z elektronów tego pierwiastka zajmuje w stanie podstawowym..
Kolumny pionowe nazywane są grupami. Każdy pierwiastek w grupie ma tę samą liczbę elektronów walencyjnych i zazwyczaj zachowują się w podobny sposób w stosunku do innych pierwiastków..
Ostatnie dwa rzędy, lantanowce i aktynowce, należą do grupy 3B i są wymienione oddzielnie..
Poznaj nazwę elementu
Wiele okresowych tablic zawiera również pełną nazwę przedmiotu. Jest to przydatne, jeśli chodzi o poznanie elementu, ponieważ nie zawsze możesz zapamiętać symbole wszystkich elementów.
Zapoznaj się z masą atomową pierwiastka wyrażoną w atomowych jednostkach masy
Liczba ta odnosi się do średniej ciężkiej masy izotopów pierwiastka chemicznego. Oryginalny układ okresowy Mendelejewa został zorganizowany w taki sposób, że pierwiastki były wyświetlane w porządku rosnącym według masy atomowej lub wagi..
Zidentyfikuj typy elementów
Wiele tabel okresowych identyfikuje różne typy pierwiastków, używając różnych kolorów dla różnych typów elementów.
Te typy obejmują metale alkaliczne, metale nieszlachetne, metale przejściowe, niemetale, gazy szlachetne, alogeny, ziemie alkaliczne, półmetale, aktynowce i lantanowce..
Pokaż różne trendy (okresowość)
Układ okresowy jest tak zorganizowany, aby pokazywać różne typy trendów (okresowość). Między nimi:
- Promień atomowy, który stanowi połowę odległości między środkami dwóch atomów, które ledwie się stykają:
- Zwiększa się, gdy przechodzisz od góry do dołu układu okresowego.
- Opada, gdy porusza się od lewej do prawej przez układ okresowy.
- Energia jonizacji, czyli energia potrzebna do usunięcia elektronu z atomu.
- Opada, gdy porusza się w górę iw dół układu okresowego.
- Zwiększa się, gdy przechodzisz od lewej do prawej w układzie okresowym.
- Elektroujemność, która mierzy zdolność do tworzenia wiązania chemicznego.
- Opada, gdy porusza się w górę iw dół.
- Zwiększa się w miarę przechodzenia od lewej do prawej.
- Powinowactwo elektronowe, które odnosi się do zdolności pierwiastka do przyjęcia elektronu.
Powinowactwo elektronów można przewidzieć na podstawie grup pierwiastków. Gazy szlachetne, takie jak argon i neon, mają prawie zerowe powinowactwo do elektronów i zwykle nie przyjmują elektronów..
Halogeny, takie jak chlor i jod, mają duże powinowactwa do elektronów. Większość innych grup pierwiastków ma powinowactwo elektronowe niższe niż allogenów, ale znacznie wyższe niż gazy szlachetne..
Bibliografia
- Jaki jest cel układu okresowego? Odzyskany z reference.com
- Jak korzystać z układu okresowego (2017) Odzyskany z thinkco.com
- Jak zorganizowane są elementy układu okresowego? Odzyskany z reference.com
- Układ okresowy. Odzyskany z wikipeda.org
- Dlaczego układ okresowy jest przydatny. Odzyskany z reference.com



Jeszcze bez komentarzy