
Właściwości nadtlenków, nazewnictwo, zastosowania, przykłady
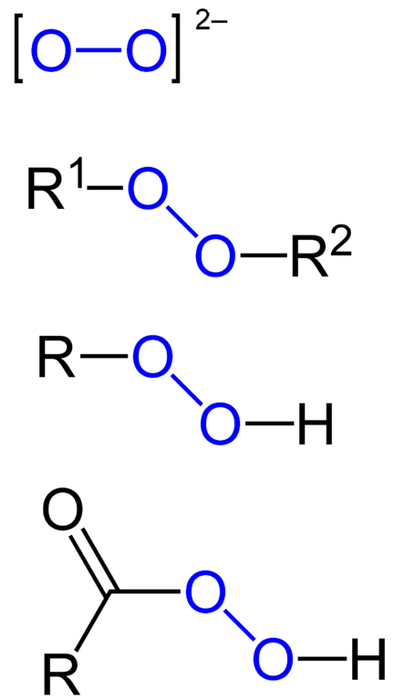
Plik nadtlenki to wszystkie te związki chemiczne, które zawierają grupę nadtlenkową O-O, albo kowalencyjnie związane z atomami węgla lub innymi grupami funkcyjnymi, albo w postaci jonowej, takiej jak anion nadtlenkowy, Odwadwa-. Powyższe jest przedstawione graficznie na poniższym obrazku. W nim grupa O-O jest podświetlona na niebiesko.
Mogą występować organiczne nadtlenki, takie jak nadtlenki diakilu (R.1-O-O-Rdwa), wodoronadtlenki (R-O-O-H), nadkwasy (RCO-O-O-H) i periestery (R1CO-O-O-Rdwa). Mamy również nadtlenki nieorganiczne, takie jak nadtlenki metali (M.n+LUBdwadwa-) i nadtlenek wodoru (H-O-O-H). Najbardziej znany jest ten ostatni, nazwany nadtlenkiem wodoru.
Wszystkie nadtlenki mają wspólną właściwość bycia wysoce reaktywnymi, utleniającymi, aw niektórych przypadkach wybuchowymi. Jeśli nie zostaną zsyntetyzowane, są uważane za niepożądane i niebezpieczne zanieczyszczenia w wielu procesach przemysłowych i syntezie laboratoryjnej..
Ogólnie nadtlenki są doskonałymi środkami utleniającymi, wybielającymi, bakteriobójczymi i aktywatorami polimeryzacji poprzez tworzenie wolnych rodników. Dlatego są zwykle bardzo przydatnymi odczynnikami lub dodatkami w przemyśle polimerowym, a także w przemyśle spożywczym, przyspieszającym utlenianie i eliminującym bakterie..
Indeks artykułów
- 1 Właściwości nadtlenków
- 1.1 Struktura
- 1.2 Reaktywność
- 1.3 Działanie utleniające
- 1.4 Czułość
- 2 Nazewnictwo
- 3 Szkolenie
- 4 Zastosowania nadtlenków
- 4.1 Inicjatory polimeryzacji
- 4.2 Wybielacze i środki dezynfekujące
- 4.3 Utleniacze
- 4.4 Źródła tlenu
- 5 Przykłady nadtlenków
- 6 Odnośniki
Właściwości nadtlenków
Struktura
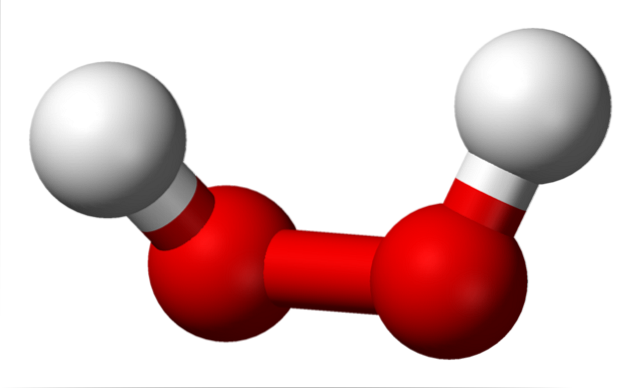
Struktury nadtlenków skupione są wokół grupy O-O. Każdy atom tlenu ma hybrydyzację sp3, więc połączenia -O-O- nie spoczywają na tej samej płaszczyźnie. Na przykład w przypadku nadtlenku wodoru H-O-O-H kąt utworzony między dwoma Hs wynosi 115,5 °, co wskazuje, że cztery atomy nie znajdują się w jednej płaszczyźnie..
Zniekształcenia tego i innych kątów będą zależały od tożsamości innych fragmentów cząsteczek połączonych z grupą O-O..
Z drugiej strony, organiczne i nieorganiczne nadtlenki (z wyjątkiem metalicznych) można rozpoznać gołym okiem, jeśli grupa O-O jest wyszczególniona w ich strukturze, jak dwie szklanki z „ustami”. W ten sposób każdy nadtlenek jest natychmiast identyfikowany jednym spojrzeniem na jego strukturę..
Reaktywność
Wiązanie O-O jest stosunkowo słabe w porównaniu z innymi wiązaniami, takimi jak C-H lub C-O. Dlatego ma tendencję do rozpadu lub fragmentacji, tworząc wysoce reaktywne utlenione rodniki..
To właśnie z powodu tych rodników nadtlenki są klasyfikowane jako substancje reaktywne i niebezpieczne, ponieważ mogą ogólnie uszkadzać tkanki i każdą materię organiczną..
Działanie utleniające
Nadtlenki są silnymi utleniaczami, których celem jest pozyskiwanie elektronów z otoczenia w celu ich przekształcenia w wodę, tlen lub wodorotlenki. Na przykład nadtlenek wodoru jest silniejszym środkiem utleniającym niż sam nadmanganian potasu..
To działanie utleniające służy do wykrywania ich w reakcji z siarczanem żelazawym i tiocyjanianem potasu:
Nadtlenek + Fedwa+ + SCN- → Fe (SCN)n(3-n)- (n = 1 do 6).
Kompleks utworzony między Fe3+ i SNA- jest koloru krwistoczerwonego, więc obserwacja tego koloru odpowiada pozytywnemu testowi na obecność nadtlenków w próbce.
Wrażliwość
Nadtlenki to substancje wrażliwe na wysokie temperatury i światło słoneczne. Dlatego należy je przechowywać w bezpiecznych miejscach oraz w nieprzezroczystych plastikowych pojemnikach, tak aby światło nie padało bezpośrednio na nie..
Nomenklatura
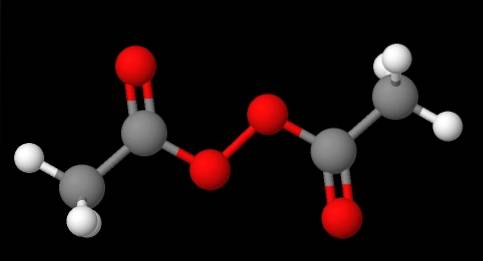
Nazewnictwo nadtlenków zależy od ich rodzaju. Ogólnie, wiele z nich jest nazwanych przez wymienienie „nadtlenku”, po którym następują podstawniki R w porządku alfabetycznym. Na przykład związek CH3C (O) OOC (O) CH3 (dolny obraz) nazywany jest nadtlenkiem diacetylu lub acetylu, ponieważ ma grupę acetylową na każdym końcu.
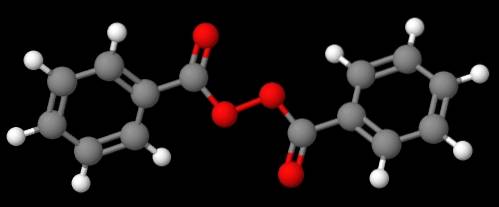
Związek C6H.5C (O) OOC (O) C6H.5 (dolny obraz), z drugiej strony nazywany jest nadtlenkiem dibenzoilu lub benzoilu, z tych samych powodów, które wyjaśniono w poprzednim akapicie.
Tymczasem związek C6H.5C (O) OOC (O) CH3 Nazywa się to nadtlenkiem acetylobenzoilu. Tym razem podstawnik acetylowy jest wymieniany jako pierwszy zaczynając od litery „a”. Innym przykładem jest CH3CHdwaOOC6H.5, zwany nadtlenkiem etylofenylu.
W podobny sposób postępujemy z wodoronadtlenkami. Na przykład CH3OOH nazywany jest wodoronadtlenkiem metylu.
Trening
Niektóre nadtlenki mogą powstawać bezpośrednio w wyniku wystawienia danej substancji na działanie tlenu z powietrza, wspomaganego lub nie z użyciem katalizatorów metalicznych. Mogą również powstawać poprzez wystawienie substancji na działanie ozonu w określonych warunkach, przeprowadzając reakcję ozonolizy..
Inną drogą syntezy jest reakcja nadtlenku wodoru z siarczanem alkilu:
Rdwapołudniowy zachód4 + H.dwaLUBdwa → R-O-O-R + Hdwapołudniowy zachód4
W celu syntezy lub tworzenia nadtlenków dialkilowych lub nawet cyklicznych nadtlenków.
W międzyczasie, kilka metod tworzenia nadtlenków metali opiera się na utlenianiu odpowiednich tlenków metali, dzięki czemu „utleniają się” i przestają być MO (Mn+LUBdwa-) miłośćdwa (M.n+LUBdwadwa-).
Zastosowania nadtlenków
Inicjatory polimeryzacji
Nadtlenki, zwłaszcza nadtlenki organiczne, dodawane są do mediów reakcyjnych w celu syntezy nieskończoności tworzyw sztucznych i materiałów, takich jak między innymi polistyren, silikon, żywice epoksydowe i akrylowe, polichlorek winylu, włókno szklane..
Dzieje się tak, ponieważ ulegają one rozkładowi termicznemu, aby stać się utlenionymi wolnymi rodnikami, które z kolei wyzwalają i katalizują polimeryzację. Dlatego są pożądane w przemyśle polimerów..
Niektóre z nadtlenków stosowanych jako inicjatory to nadtlenek ketonu metylowo-etylowego (MEK) i nadtlenek acetonu.
Wybielacze i środki dezynfekujące
Nadtlenki to środki wybielające stosowane do bielenia masy papierniczej i mąki. Podobnie są środkami dezynfekującymi, całkowicie skutecznymi, choć agresywnymi w zwalczaniu bakterii. Klasyczny przykład to nadtlenek wodoru, stosowany w rozcieńczonych (3%) roztworach do dezynfekcji ran..
Utleniacze
Nadtlenki są również utleniaczami, dlatego znajdują wiele zastosowań w organicznych syntezach substancji silnie natlenionych..
Źródła tlenu
Chociaż nie jest to jedno z jego głównych zastosowań, nadtlenki mogą również służyć jako źródło tlenu w niektórych jego rozkładach. Tak jest znowu w przypadku nadtlenku wodoru.
Przykłady nadtlenków
Na koniec zostaną wymienione przykłady nadtlenków, zarówno organicznych, jak i nieorganicznych, wraz z ich wzorami i odpowiednimi nazwami:
-H.dwaLUBdwa: nadtlenek wodoru lub nadtlenek wodoru
-NadwaLUBdwa: nadtlenek sodu
-Belkadwa: nadtlenek baru
-do6H.5C (CH3)dwaOOH: wodoronadtlenek kumenu
-(NH4)dwaSdwaLUB8: Nadsiarczan amonu
- HO3SOOSO3H: kwas nadtlenodisiarczkowy
-(CH3)3COOC (CH3)3: nadtlenek ditert-butylu
Bibliografia
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. (10th wydanie.). Wiley plus.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2020). Nadtlenek organiczny. Odzyskane z: en.wikipedia.org
- Elsevier B.V. (2020). Nadtlenek. ScienceDirect. Odzyskany z: sciencedirect.com
- Zaawansowany rozwój chemii. (s.f.). Alkohole, fenole i ich pochodne:
- Reguła dotycząca nadtlenków C-218. Odzyskany z: acdlabs.com
- Vol'nov I.I., Petrocelli A.W. (1966) Klasyfikacja i nazewnictwo nieorganicznych związków nadtlenkowych. W: Petrocelli A.W. (red.) Nadtlenki, nadtlenki i ozonki metali alkalicznych i ziem alkalicznych. Springer, Boston, MA.



Jeszcze bez komentarzy