
Okresowe właściwości pierwiastków i ich charakterystyka

Plik Okresowe właściwości pierwiastków to te, które określają ich fizyczne i chemiczne zachowanie z perspektywy atomowej i których wielkości, oprócz liczby atomowej, pozwalają na klasyfikację atomów.
Ze wszystkich właściwości te charakteryzują się, jak wskazuje ich nazwa, okresowością; to znaczy, jeśli badany jest układ okresowy, będzie można poświadczyć, że jego wielkości są zgodne z trendem, który zbiega się i powtarza z uporządkowaniem elementów w okresach (wierszach) i grupach (kolumnach).

Na przykład, jeśli przekroczy się okres, a właściwość okresowa zmniejszy swoją wielkość z każdym elementem, to samo stanie się z nią we wszystkich okresach. Z drugiej strony, jeśli spadek grupy lub kolumny zwiększa jej wielkość, można oczekiwać, że to samo stanie się z innymi grupami..
I tak, jego odmiany są powtarzane i wykazują prostą tendencję, która zgadza się z uporządkowaniem pierwiastków według ich liczb atomowych. Właściwości te są bezpośrednio odpowiedzialne za metaliczny lub niemetaliczny charakter pierwiastków, a także ich reaktywność, co pomogło w ich dokładniejszej klasyfikacji..
Gdyby przez chwilę tożsamość pierwiastków była nieznana i były postrzegane jako dziwne „kule”, układ okresowy można by odbudować (przy dużym nakładzie pracy) wykorzystując te właściwości.
W ten sposób domniemane kule uzyskałyby kolory, które pozwoliłyby odróżnić je od siebie w grupach (górny rysunek). Znając ich właściwości elektroniczne, można je uporządkować w okresy, a grupy ujawniłyby te, które mają taką samą liczbę elektronów walencyjnych.
Uczenie się i rozumowanie na temat właściwości okresowych to to samo, co wiedza, dlaczego elementy reagują w taki czy inny sposób; to wiedzieć, dlaczego elementy metalowe znajdują się w pewnych obszarach stołu, a elementy niemetalowe w innych.
Indeks artykułów
- 1 Jakie są właściwości okresowe i ich charakterystyka
- 1.1 -Atomiczny promień
- 1.2 -Elektronoujemność
- 1.3 -Metaliczny charakter
- 1.4 - Energia jonizacji
- 1.5 -Elektroniczne powinowactwo
- 2 Odnośniki
Jakie są właściwości okresowe i ich charakterystyka
-Radio atomowe
Obserwując kule na obrazie, pierwszą rzeczą, którą można zauważyć, jest to, że nie wszystkie są tej samej wielkości. Niektóre są bardziej masywne niż inne. Jeśli przyjrzysz się dokładniej, zauważysz, że te rozmiary różnią się w zależności od wzoru: w jednym okresie zmniejsza się od lewej do prawej, a w grupie zwiększa się od góry do dołu..
Powyższe można również powiedzieć w ten sposób: promień atomowy maleje w kierunku grup lub kolumn po prawej stronie i rośnie w dolnych okresach lub rzędach. W takim przypadku promień atomowy jest pierwszą właściwością okresową, ponieważ jego zmiany podążają za wzorem w elementach..
Ładunek jądrowy a elektrony
Dlaczego ten wzór? W pewnym okresie elektrony atomu zajmują ten sam poziom energii, co jest związane z odległością dzielącą je od jądra. Kiedy przechodzimy z jednej grupy do drugiej (co jest tym samym, co przechodzenie przez okres po prawej stronie), jądro dodaje zarówno elektrony, jak i protony na tym samym poziomie energii..
Dlatego elektrony nie mogą zajmować dalszych odległości od jądra, co zwiększa jego dodatni ładunek, ponieważ ma więcej protonów. W konsekwencji elektrony odczuwają większą siłę przyciągania do jądra, przyciągając je coraz bardziej wraz ze wzrostem liczby protonów..
Dlatego pierwiastki po prawej stronie układu okresowego (żółte i turkusowe kolumny) mają najmniejsze promienie atomowe..
Z drugiej strony, kiedy „przeskakujesz” z jednego okresu do drugiego (co jest tym samym, co powiedzenie, że schodzisz w dół grupy), nowe poziomy energii umożliwiają elektronom zajmowanie bardziej odległych przestrzeni od jądra. Będąc dalej, jądro (z większą liczbą protonów) przyciąga je z mniejszą siłą; a zatem promienie atomowe rosną.
Promienie jonowe
Promienie jonowe mają podobny wzór do promieni atomowych; Jednak nie zależą one tak bardzo od jądra, ale od tego, ile lub mniej elektronów ma atom w odniesieniu do jego stanu neutralnego.
Kationy (Na+, ACdwa+, Do3+, Byćdwa+, Wiara3+) wykazują ładunek dodatni, ponieważ stracili jeden lub więcej elektronów, a zatem jądro przyciąga je z większą siłą, ponieważ między nimi jest mniej odpychania. Wynik: kationy są mniejsze niż atomy, z których pochodzą.
A dla anionów (Odwa-, fa-, Sdwa-, ja-) wręcz przeciwnie, wykazują one ładunek ujemny, ponieważ mają jeden lub więcej elektronów w nadmiarze, zwiększając wzajemne odpychanie ponad siłę przyciągania wywieranego przez jądro. Wynik: aniony są większe niż atomy, z których pochodzą (zdjęcie poniżej).
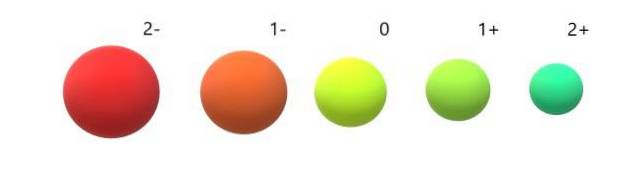
Ocenia się, że anion 2- jest najbardziej obszerny ze wszystkich, a kation 2+ najmniejszy. Promienie zwiększają się, gdy atom jest naładowany ujemnie, i kurczy się, gdy jest naładowany dodatnio..
-Elektroujemność
Kiedy pierwiastki mają małe promienie atomowe, nie tylko ich elektrony są bardzo silnie przyciągane, ale także elektrony z sąsiednich atomów, kiedy tworzą wiązanie chemiczne. Ta tendencja do przyciągania elektronów z innych atomów w związku jest znana jako elektroujemność..
To, że atom jest mały, nie oznacza, że będzie bardziej elektroujemny. Jeśli tak, to pierwiastki hel i wodór byłyby najbardziej elektroujemnymi atomami. Hel, jak wykazała nauka, nie tworzy żadnego wiązania kowalencyjnego; a wodór ma tylko jeden proton w jądrze.
Kiedy promienie atomów są duże, jądra nie mają wystarczającej siły, aby przyciągnąć elektrony z innych atomów; dlatego pierwiastkami najbardziej elektroujemnymi są te o małym promieniu atomowym i większej liczbie protonów.
Ponownie, te, które doskonale spełniają te cechy, to niemetaliczne elementy bloku p układu okresowego; Są to te należące do grupy 16 lub tlenu (O, S, Se, Te, Po) oraz grupy 17 lub fluoru (F, Cl, Br, I, At).
Tendencja
Zgodnie z tym wszystkim, co zostało powiedziane, najbardziej elektroujemne pierwiastki znajdują się zwłaszcza w prawym górnym rogu układu okresowego; z fluorem jako pierwiastkiem, który stoi na czele listy najbardziej elektroujemnych.
Dlaczego? Bez uciekania się do skal elektroujemności (Pauling, Mulliken itp.), Chociaż fluor jest większy niż neon (gaz szlachetny swojego okresu), ten pierwszy może tworzyć wiązania, podczas gdy drugi nie. Ponadto, ze względu na mały rozmiar, jego jądro ma wiele protonów, a tam, gdzie jest fluor, wystąpi moment dipolowy.
-Metaliczny charakter
Jeśli pierwiastek ma promień atomowy w porównaniu do tych z tego samego okresu, a także nie jest bardzo elektroujemny, to jest metalem i ma wysoce metaliczny charakter.
Jeśli wrócimy do głównego obrazu, czerwonawe i zielonkawe kule, podobnie jak szare, odpowiadają metalowym elementom. Metale mają wyjątkowe cechy i stąd ich okresowe właściwości zaczynają przeplatać się z fizycznymi i makroskopowymi właściwościami materii..
Pierwiastki o wysokim charakterze metalicznym charakteryzują się stosunkowo dużymi atomami, łatwo zgubionymi elektronami, ponieważ jądra z trudem je do nich przyciągają..
W rezultacie łatwo ulegają utlenieniu lub utracie elektronów, tworząc kationy, M.+; nie oznacza to, że wszystkie kationy są metaliczne.
Tendencja
W tym momencie możesz przewidzieć, jak zmienia się charakter metaliczny w układzie okresowym. Jeśli wiadomo, że metale mają duże promienie metaliczne i że są one również mało elektroujemne, należy oczekiwać, że najcięższe pierwiastki (niższe okresy) są najbardziej metaliczne; a najlżejsze elementy (górne okresy), mniej metaliczne.
Ponadto metaliczny charakter maleje, im bardziej elektroujemny staje się pierwiastek. Oznacza to, że przechodząc przez okresy i grupy po prawej stronie układu okresowego, w swoich górnych okresach, znajdą pierwiastki mniej metaliczne..
W związku z tym metaliczny charakter rośnie opadając przez grupę i maleje od lewej do prawej w tym samym okresie. Wśród pierwiastków metalicznych mamy: Na (sód), Li (lit), Mg (magnez), Ba (bar), Ag (srebro), Au (złoto), Po (polon), Pb (ołów), Cd (kadm) ), Al (aluminium) itp.
-Energia jonizacji
Jeśli atom ma duży promień atomowy, należy się spodziewać, że jego jądro nie będzie utrzymywać elektronów w zewnętrznych powłokach uwięzionych ze znaczną siłą. W konsekwencji usunięcie ich z atomu w fazie gazowej (zindywidualizowanej) nie będzie wymagało dużo energii; to znaczy energia jonizacji, EI, potrzebna do usunięcia z nich elektronu.
EI jest również równoznaczne z powiedzeniem, że jest to energia, która musi być dostarczona, aby pokonać siłę przyciągania jądra atomu lub jonu gazowego na jego najbardziej zewnętrznym elektronie. Im mniejszy atom i im bardziej elektroujemny, tym niższa jest jego EI; to jest twój trend.
Poniższe równanie ilustruje przykład:
Na (g) => Na+(g) + e-
EI potrzebna do osiągnięcia tego nie jest tak duża w porównaniu z drugą jonizacją:
Na+(g) => Nadwa+(g) + e-
Ponieważ w Na+ przeważają ładunki dodatnie, a jon jest mniejszy niż atom obojętny. W konsekwencji jądro Na+ przyciąga elektrony ze znacznie większą siłą, wymagając znacznie większej EI.
-Elektroniczne powinowactwo
I wreszcie, istnieje okresowa właściwość powinowactwa elektronicznego. Jest to energetyczna tendencja atomu pierwiastka w fazie gazowej do przyjmowania elektronu. Jeśli atom jest mały i ma jądro o dużej sile przyciągania, z łatwością przyjmie elektron, tworząc stabilny anion..
Im bardziej stabilny jest anion w stosunku do swojego neutralnego atomu, tym większe jest jego powinowactwo do elektronów. Jednak w grę wchodzą również odpychania między samymi elektronami.
Na przykład azot ma większe powinowactwo do elektronów niż tlen. Dzieje się tak, ponieważ jego trzy elektrony 2p są niesparowane i odpychają się nawzajem, a nadchodzący elektron mniej; podczas gdy w tlenie istnieje para sparowanych elektronów, które wywierają większe odpychanie elektroniczne; aw przypadku fluoru są dwie pary.
Z tego powodu mówi się, że trend w elektronicznym powinowactwie normalizuje się od trzeciego okresu układu okresowego..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemia. (8th ed.). CENGAGE Learning.
- Prof. Ortega Graciela M. (1 kwietnia 2014). Okresowe właściwości pierwiastków. Kolor abc. Odzyskany z: abc.com.py
- Chemia LibreTexts. (7 czerwca 2017). Okresowe właściwości pierwiastków. Źródło: chem.libretexts.org
- Helmenstine, dr Anne Marie (02 stycznia 2019). Okresowe właściwości pierwiastków. Odzyskany z: thinkco.com
- Toppr. (s.f.). Okresowe właściwości pierwiastków. Odzyskane z: toppr.com /
- Okresowe właściwości elementów: podróż przez stół to podróż przez chemię. [PDF]. Odzyskany z: cod.edu


Jeszcze bez komentarzy