
Jaki jest punkt równoważności i do czego służy?
Plik punkt równoważności To taki, w którym całkowicie przereagowały dwie substancje chemiczne. W reakcjach kwasowo-zasadowych ten punkt wskazuje, kiedy cały kwas lub zasada została zneutralizowana. Ta koncepcja jest chlebem powszednim miareczkowania lub wyceny wolumetrycznej i jest określana za pomocą prostych obliczeń matematycznych.
Ale jaki jest stopień? Jest to proces, w którym do roztworu o nieznanym stężeniu ostrożnie dodaje się objętość roztworu o znanym stężeniu, zwanego titrantem, w celu uzyskania jego stężenia.

Zastosowanie wskaźnika pH pozwala poznać moment zakończenia miareczkowania. Wskaźnik jest dodawany do roztworu, który jest miareczkowany, aby dokonać ilościowego określenia stężenia, którego znajomość jest pożądana. Wskaźnik kwasowo-zasadowy to związek chemiczny, którego kolor zależy od stężenia wodoru lub pH medium..
Jednak zmiana koloru wskaźnika wskazuje punkt końcowy miareczkowania, ale nie punkt równoważnikowy. W idealnym przypadku oba punkty powinny się pokrywać; ale w rzeczywistości zmiana koloru może nastąpić w ciągu kilku kropli po zakończeniu neutralizacji kwasu lub zasady..
Indeks artykułów
- 1 Jaki jest punkt równoważności?
- 1.1 Punkt końcowy
- 2 Punkt równoważności miareczkowania mocnego kwasu mocną zasadą
- 3 Krzywa miareczkowania słabej zasady kwasowo-mocnej
- 3.1 Etapy
- 3.2 Wybór wskaźnika według punktu równoważnikowego
- 4 Odnośniki
Jaki jest punkt równoważności?
Roztwór kwasu o nieznanym stężeniu umieszczony w kolbie można miareczkować przez powolne dodawanie roztworu wodorotlenku sodu o znanym stężeniu za pomocą biurety..
Doboru wskaźnika należy dokonać w taki sposób, aby zmieniał kolor w momencie, gdy przereagowała taka sama ilość równoważników chemicznych roztworu titranta i roztworu o nieznanym stężeniu..
Jest to punkt równoważności, podczas gdy punkt, w którym wskaźnik zmienia kolor, nazywany jest punktem końcowym, w którym kończy się miareczkowanie..
Punkt końcowy
Jonizacja lub dysocjacja wskaźnika jest przedstawiona w następujący sposób:
HIn + HdwaLUB <=> W- + H.3LUB+
I dlatego ma stałą Ka
Ka = [H.3LUB+] [W-] / [HIn]
Zależność między niezdysocjowanym wskaźnikiem (HIn) a zdysocjowanym wskaźnikiem (In-) określa kolor wskaźnika.
Dodatek kwasu zwiększa stężenie HIn i daje kolor wskaźnikowy 1. Tymczasem dodanie zasady sprzyja wzrostowi stężenia zdysocjowanego wskaźnika (In-) (kolor 2).
Pożądane jest, aby punkt równoważności był zgodny z punktem końcowym. W tym celu wybiera się wskaźnik z interwałem zmiany koloru, który zawiera punkt równoważności. Ponadto próbuje zredukować wszelkie błędy, które powodują różnicę między punktem równoważności a punktem końcowym.
Standaryzacja lub miareczkowanie roztworu to proces, w którym określa się dokładne stężenie roztworu. Jest to stopień metodologiczny, ale przyjęta strategia jest inna.
Roztwór podstawowego wzorca umieszcza się w kolbie, a roztwór titranta, który jest standaryzowany, dodaje się za pomocą biurety..
Punkt równoważności miareczkowania mocnego kwasu mocną zasadą
W kolbie umieszcza się 100 ml 0,1 M HCl i stopniowo dodaje się przez biuretę 0,1 M roztwór NaOH, określając zmiany pH roztworu, z którego pochodzi kwas solny.
Początkowo przed dodaniem NaOH pH roztworu HCl wynosi 1.
Dodaje się mocną zasadę (NaOH) i pH stopniowo wzrasta, ale nadal jest to pH kwaśne, ponieważ nadmiar kwasu określa to pH.
Jeśli będziesz kontynuować dodawanie NaOH, nadejdzie czas, gdy zostanie osiągnięty punkt równoważnikowy, w którym pH jest obojętne (pH = 7). Kwas przereagował ze zużywaną zasadą, ale nie ma jeszcze nadmiaru zasady.
Stężenie chlorku sodu, który jest solą obojętną (ani Na+ ani Cl- zmydlać się).
Jeśli będziesz kontynuować dodawanie NaOH, pH nadal rośnie, stając się bardziej zasadowym niż punkt równoważnikowy, ponieważ przeważa stężenie NaOH..
Idealnie, zmiana koloru wskaźnika powinna nastąpić przy pH = 7; ale ze względu na ostry kształt krzywej miareczkowania można zastosować fenoloftaleinę, która zmienia się w bladoróżowy kolor przy pH około 8.
Krzywa miareczkowania słabej zasady kwasowo-mocnej
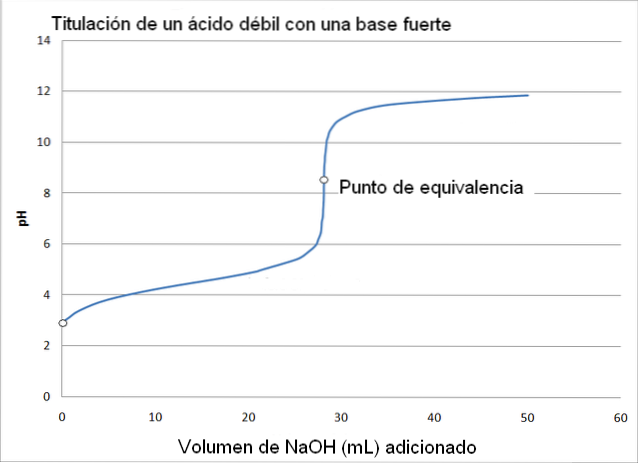
W tym przypadku słaby kwas, taki jak kwas octowy (CH3COOH) z mocną zasadą, wodorotlenkiem sodu (NaOH). Reakcję zachodzącą podczas miareczkowania można opisać w następujący sposób:
NaOH + CH3COOH => CH3GRUCHAĆ-Na+ + H.dwaLUB
W tym przypadku powstaje bufor octanowy o pKa = 4,74. Obszar zbuforowany można zobaczyć w niewielkiej i prawie niezauważalnej zmianie przed pH 6.
Punkt równoważności, jak pokazuje obraz, wynosi około 8,72, a nie 7. Dlaczego? Ponieważ CH3GRUCHAĆ- jest anionem, który po hydrolizie generuje OH-, który alkalizuje pH:
CH3GRUCHAĆ- + H.dwaLUB <=> CH3COOH + OH-
Gradacja
Miareczkowanie kwasu octowego wodorotlenkiem sodu można podzielić na 4 etapy analizy.
-Przed rozpoczęciem dodawania zasady (NaOH) pH roztworu jest kwaśne i zależy od dysocjacji kwasu octowego.
-W miarę dodawania wodorotlenku sodu powstaje buforowy roztwór octanowy, ale w ten sam sposób wzrasta tworzenie zasady sprzężonej z octanem, co pociąga za sobą wzrost pH roztworu..
-PH punktu równoważnikowego występuje przy pH 8,72, które jest szczerze alkaliczne..
Punkt równoważnikowy nie ma stałej wartości i zmienia się w zależności od związków biorących udział w miareczkowaniu..
-W miarę dodawania NaOH, po osiągnięciu punktu równoważnikowego, pH wzrasta z powodu nadmiaru wodorotlenku sodu.
Wybór wskaźnika według punktu równoważności
Fenoloftaleina jest przydatna do określania punktu równoważnikowego w tym miareczkowaniu, ponieważ ma punkt zmiany koloru przy pH około 8, które mieści się w strefie pH miareczkowania kwasem octowym, która obejmuje równoważnik punktowy (pH = 8,72).
Z drugiej strony czerwień metylowa nie jest przydatna do określania punktu równoważnikowego, ponieważ zmienia kolor w zakresie pH od 4,5 do 6,4.
Bibliografia
- Wikipedia. (2018). Punkt równoważności. Odzyskane z: es.wikipedia.org
- Helmenstine, dr Anne Marie (22 czerwca 2018). Definicja punktu równoważnego. Odzyskany z: thinkco.com
- Lusi Madisha. (16 kwietnia 2018). Różnica między punktem końcowym a punktem równoważnym ”. DifferenceBetween.net. Odzyskany z: Differencebetween.net
- Spójrz J. (2018). Punkt równoważności: definicja i obliczenia. Odzyskany z: study.com
- Whitten, K. W., Davis, R. E., Peck, L. P. & Stanley, G. G. Chemistry. (2008) ósme wydanie. Cengage Learning Editors.



Jeszcze bez komentarzy