
Czym są triady Döbereinera?

Plik Triady Döbereinera Są to grupy trzech pierwiastków chemicznych, które mają podobne cechy. Są częścią 118 pierwiastków chemicznych, będących różnorodnością przedstawionych reakcji i ich związków, ich najbardziej fascynującym aspektem.
Ideą klasyfikacji pierwiastków jest odpowiednie potraktowanie ich właściwości chemicznych bez konieczności opracowywania zestawu reguł i teorii dla każdego z nich z osobna..
Ich okresowa klasyfikacja dostarczyła niezwykle użytecznych systematycznych ram do skorelowania ich według kilku bardzo prostych i logicznych wzorców..
Pierwiastki są systematycznie układane w rzędy i kolumny z rosnącymi liczbami atomowymi, a miejsce zostało zarezerwowane na nowe odkrycia..
W 1815 r. Znanych było tylko około 30 pozycji. Chociaż dostępnych było wiele informacji na temat tych i ich związków, nie było wyraźnego porządku.
Podjęto kilka prób ustalenia kolejności, jednak trudno było uporządkować wszystko, co było znane, więc wielu naukowców zaczęło szukać w jej właściwościach jakiegoś wzoru, który pozwoliłby zaradzić tej sytuacji..
Odkrycie triad Döbereinerów
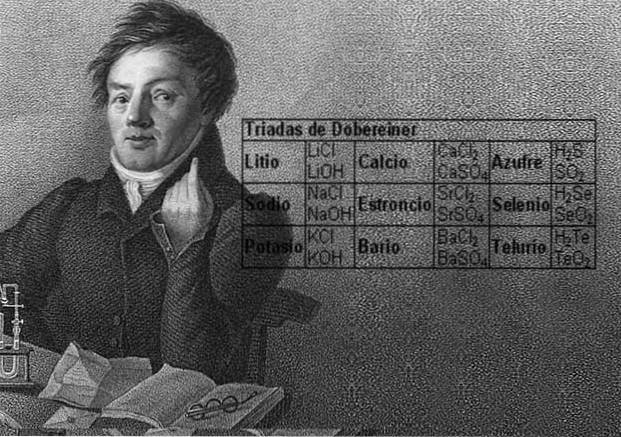
Naukowiec Johann Wolfgang Döbereiner dokonał ważnych ustaleń dotyczących numerycznej prawidłowości między masami atomowymi pierwiastków, jako pierwszy zauważył istnienie kilku grup trzech pierwiastków, które nazwał triadami, które wykazywały podobieństwa chemiczne.
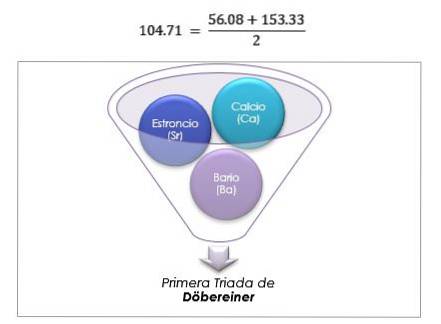
Pierwiastki te ujawniły ważną zależność liczbową, ponieważ po uporządkowaniu według ich masy równoważnej lub masy atomowej waga elementu centralnego okazała się przybliżoną średnią z dwóch pozostałych pierwiastków w triadzie..
W 1817 roku Döbereiner odkrył, że gdyby pewne pierwiastki były połączone z tlenem w związkach dwuskładnikowych, można było dostrzec zależność liczbową między równoważnymi masami tych związków.
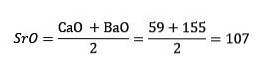
Obserwacje Döbereinera miały początkowo niewielki wpływ na świat chemiczny, ale później stały się bardzo wpływowe. Dziś uważany jest za jednego z pionierów w rozwoju układu okresowego..
Dwanaście lat później, w 1829 roku, Döbereiner dodał trzy nowe triady, które pokazano poniżej:
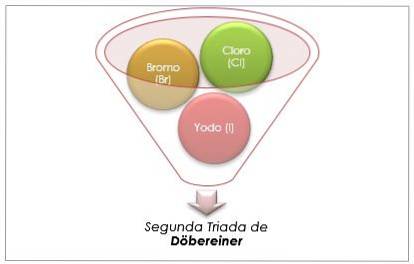
Grupa halogenowa
Chlor, brom i jod mają podobne właściwości chemiczne i tworzą triadę. Te pierwiastki są wysoce reaktywnymi niemetalami. Jeśli są wymienione w kolejności rosnącej masy względnej, to kolejność malejącej reaktywności. Brom ma pośrednią masę atomową między chlorem a jodem.

Masa atomowa pierwiastka średniego Brom (Br) jest równa średniej mas atomowych chloru (Cl) i jodu (I).
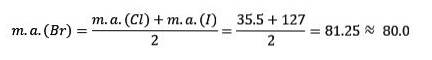
Średnia uzyskana wartość jest zbliżona do masy atomowej bromu (Br).
Podobieństwa we właściwościach chemicznych:
- Wszystkie są niemetalowe.
- Wszystkie reagują z wodą tworząc kwasy (np. W: HCl, HBr, HF).
- Wszystkie mają wartościowość równą jeden (na przykład w: HCl, HBr, HF).
- Wszystkie z nich reagują z metalami alkalicznymi, tworząc obojętne sole (np. NaCl, NaBr, NaI)
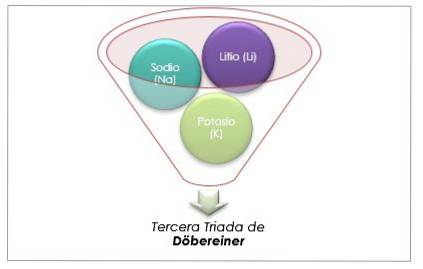
Grupa metali alkalicznych
Lit, sód i potas mają podobne właściwości chemiczne i tworzą triadę. Te pierwiastki to miękkie i lekkie metale, ale bardzo reaktywne..
Jeśli są wymienione w kolejności rosnącej względnej masy atomowej, to również w kolejności rosnącej reaktywności. Sód ma pośrednią masę atomową między litem a potasem.

Masa atomowa centralnego pierwiastka Sód (Na) jest równa średniej masy atomowej litu (Li) i potasu (K).
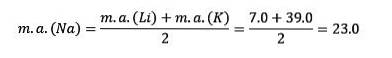
Podobieństwa we właściwościach chemicznych:
- Wszystkie są metalami.
- Wszystkie reagują z wodą, tworząc roztwory alkaliczne i wodór..
- Wszystkie mają wartościowość równą jeden (na przykład w: LiCl, NaCl, KCl).
- Jego węglany są odporne na rozkład termiczny.
Grupa chalkogenów lub amfigenów
Siarka, selen i tellur mają podobne właściwości chemiczne i tworzą triadę. Selen ma pośrednią masę atomową między siarką a tellurem.

Masa atomowa środkowego pierwiastka selenu (Se) jest równa średniej masie atomowej siarki (S) i telluru (Te).
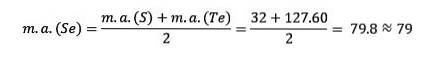
Po raz kolejny średnia uzyskana wartość jest zbliżona do masy atomowej selenu (Se).
Podobieństwa we właściwościach chemicznych:
- Kombinacje wodoru tych pierwiastków powodują powstawanie toksycznych gazów.
- Każdy z tych pierwiastków ma 6 elektronów walencyjnych.
- Właściwości metaliczne rosną wraz ze wzrostem liczby atomowej.

Döbereiner zauważył również, że triady muszą ujawniać związki chemiczne między pierwiastkami, a także związki liczbowe, aby były prawidłowe..
Z drugiej strony odmówił grupowania fluoru razem z chlorem, bromem i jodem, co mógł zrobić z powodów chemicznych, ponieważ nie znalazł triadycznego związku między masami atomowymi fluoru i tych innych halogenów..
Niechętnie rozważał również pojawienie się triad między niepodobnymi pierwiastkami, takimi jak azot, węgiel i tlen, pomimo faktu, że wykazywały one znaczącą triadyczną zależność liczbową.
Praca Dobereinera skupiała się na relacjach między elementami triady, ale nie dawała żadnych wskazówek na temat relacji między triadami..
Dość powiedzieć, że badania Döbereinera doprowadziły do ustalenia triad jako potężnej koncepcji, którą kilku innych chemików wkrótce weźmie pod uwagę..
W rzeczywistości triady Döbereinera stanowiły pierwszy krok do zgrupowania pierwiastków w pionowe kolumny w układzie okresowym i w ten sposób ustanowienia systemu, który wyjaśnia właściwości chemiczne i ujawnia fizyczne relacje pierwiastków..
Przedłużenie triad
Inni chemicy rozszerzyli triady Döbereinera, aby objąć więcej niż trzy oryginalne elementy. Na przykład fluor został dodany do górnej części triady zawierającej chlor, brom i jod..
Wytworzono inne „triady”, takie jak triady zawierające tlen, siarkę, selen i tellur. Ale nie było systemu, który by je skorelował jako całość.
Jedną z głównych wad było to, że wiele względnych mas atomowych nadal było błędnych w tamtym czasie..
Bibliografia
- Clugston, M. and Flemming, R. (2000), Advanced Chemistry. Nowy Jork, Oxford University Press.
- Johann Wolfgang Döbereiner. Odzyskany z: britannica.com.
- Sauders, N. (2010). Przełomy w nauce i technologii: kto wynalazł układ okresowy? Minnesotta, Arcturus Publishing Limited.
- Scerri, E. (2007), Układ okresowy: jego historia i znaczenie. Nowy Jork, Oxford University Press.
- Shyamal, A. (2008), Living Science Chemistry 10. New Delhi, Ratna Sagar P. Ltd.
- Co to jest grupa 16 układu okresowego? Jak są używane te elementy? Odzyskany z: quora.com.



Jeszcze bez komentarzy