
Promień atomowy, jak jest mierzony, jak się zmienia i przykłady
Plik radio atomowe jest to ważny parametr dla okresowych właściwości pierwiastków układu okresowego. Jest to bezpośrednio związane z rozmiarem atomów, ponieważ im większy promień, tym są większe lub bardziej obszerne. Podobnie jest z ich właściwościami elektronicznymi..
Im więcej elektronów ma atom, tym większy jest jego rozmiar i promień atomu. Obie są definiowane przez elektrony powłoki walencyjnej, ponieważ w odległościach poza ich orbitami prawdopodobieństwo znalezienia elektronu zbliża się do zera. W pobliżu jądra jest odwrotnie: zwiększa się prawdopodobieństwo znalezienia elektronu.

Górny obraz przedstawia opakowanie wacików. Zwróć uwagę, że każdy jest otoczony sześcioma sąsiadami, nie licząc kolejnego możliwego górnego lub dolnego rzędu. Sposób, w jaki waciki są zagęszczane, określa ich rozmiary, a tym samym promienie; podobnie jak atomy.
Pierwiastki, zgodnie z ich naturą chemiczną, oddziałują z własnymi atomami w taki czy inny sposób. W konsekwencji wielkość promienia atomowego zmienia się w zależności od typu obecnego wiązania i stałego upakowania jego atomów..
Indeks artykułów
- 1 Jak mierzony jest promień atomowy?
- 1.1 Określenie odległości międzyjądrowej
- 1.2 Jednostki
- 2 Jak to się zmienia w układzie okresowym?
- 2.1 Przez pewien okres
- 2.2 Zejście przez grupę
- 2.3 Skurcz lantanowców
- 3 przykłady
- 4 Odnośniki
Jak mierzysz promień atomowy?
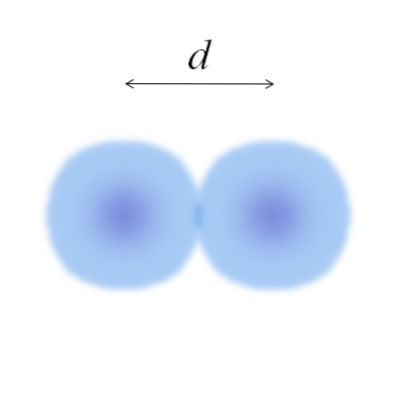
Na głównym zdjęciu można łatwo zmierzyć średnicę wacików, a następnie podzielić ją przez dwa. Jednak sfera atomu nie jest w pełni zdefiniowana. Dlaczego? Ponieważ elektrony krążą i dyfundują w określonych obszarach przestrzeni: orbitale.
Dlatego atom można uznać za kulę o niewyczuwalnych krawędziach, których nie można z całą pewnością powiedzieć, jak daleko się kończą. Na przykład na powyższym obrazku obszar w środku, blisko jądra, ma bardziej intensywny kolor, a jego krawędzie są rozmyte..
Obraz przedstawia dwuatomową cząsteczkę E.dwa (jak Cldwa, H.dwa, LUBdwa, itp.). Zakładając, że atomy są ciałami kulistymi, gdyby wyznaczono odległość re który oddziela oba jądra w wiązaniu kowalencyjnym, wystarczyłoby wówczas podzielić go na dwie połowy (re/ 2) w celu uzyskania promienia atomowego; dokładniej, kowalencyjny promień E do E.dwa.
Co by się stało, gdyby E nie utworzył ze sobą wiązań kowalencyjnych, ale był pierwiastkiem metalicznym? Następnie re wskazywałoby na to liczba sąsiadów otaczających E w jego metalicznej strukturze; to znaczy przez numer koordynacyjny (N.C) atomu wewnątrz opakowania (pamiętaj o bawełnianych kulkach na głównym zdjęciu).
Określenie odległości międzyjądrowej
Określić re, która jest odległością międzyjądrową dla dwóch atomów w cząsteczce lub opakowaniu, wymagane są techniki analizy fizycznej.
Jedną z najczęściej stosowanych jest dyfrakcja rentgenowska, w której wiązka światła jest naświetlana przez kryształ i badany jest wzór dyfrakcyjny wynikający z interakcji między elektronami a promieniowaniem elektromagnetycznym. W zależności od upakowania można uzyskać różne wzory dyfrakcji, a tym samym inne wartości re.
Jeśli atomy są „ciasne” w sieci krystalicznej, będą miały różne wartości re w porównaniu z tym, co mieliby, gdyby były „wygodne”. Podobnie, te odległości międzyjądrowe mogą zmieniać wartości, więc promień atomowy w rzeczywistości składa się ze średniej wartości takich pomiarów..
Jaki jest związek między promieniem atomowym a liczbą koordynacyjną? V. Goldschmidt ustalił związek między nimi, w którym dla NC równego 12 wartość względna wynosi 1; 0,97 dla wypełnienia, w którym atom ma N.C równy 8; 0,96 dla N.C równego 6; i 0,88 dla N.C równej 4.
Jednostki
Z wartości dla N.C równych 12 skonstruowano wiele tabel, w których porównano promienie atomowe wszystkich elementów układu okresowego.
Ponieważ nie wszystkie pierwiastki tworzą tak zwarte struktury (NC mniejsze niż 12), do obliczenia ich promieni atomowych i wyrażenia ich dla tego samego upakowania wykorzystuje się relację V. Goldschmidta. W ten sposób pomiary promieni atomowych są znormalizowane..
Ale w jakich jednostkach są one wyrażane? Biorąc pod uwagę re ma bardzo małą wielkość, musimy uciec się do jednostek angstremów Å (10 ∙ 10-10m) lub też szeroko stosowany, pikometr (10 ∙ 10-12m).
Jak to się zmienia w układzie okresowym?
Przez pewien okres
Promienie atomowe określone dla pierwiastków metalicznych nazywamy promieniami metalicznymi, natomiast dla pierwiastków niemetalicznych promienie kowalencyjne (takie jak fosfor, P4, lub siarka, S.8). Jednak między tymi dwoma typami szprych istnieje wyraźniejsze rozróżnienie niż nazwa.
Od lewej do prawej w tym samym okresie jądro dodaje protony i elektrony, ale te ostatnie są ograniczone do tego samego poziomu energii (główna liczba kwantowa). W konsekwencji jądro wywiera coraz większy efektywny ładunek jądrowy na elektrony walencyjne, które zmniejszają promień atomowy..
W ten sposób pierwiastki niemetaliczne w tym samym okresie mają zwykle mniejsze promienie atomowe (kowalencyjne) niż metale (promienie metaliczne).
Zejście przez grupę
Kiedy schodzisz przez grupę, włączane są nowe poziomy energii, które pozwalają elektronom mieć więcej miejsca. W ten sposób chmura elektronowa pokonuje większe odległości, jej rozmyty obwód w końcu oddala się od jądra, a zatem promień atomu rozszerza się..
Skurcz lantanowców
Elektrony w powłoce wewnętrznej pomagają chronić efektywny ładunek jądrowy na elektronach walencyjnych. Kiedy orbitale tworzące warstwy wewnętrzne mają wiele „dziur” (węzłów), jak ma to miejsce w przypadku orbitali f, jądro silnie kurczy promień atomowy z powodu ich słabego efektu ekranowania..
Świadczy o tym skurcz lantanowców w okresie 6 układu okresowego. Od La do Hf następuje znaczny skurcz promienia atomowego w wyniku orbitali f, które „zapełniają się”, gdy przechodzi blok f: lantanoidów i aktynoidów.
Podobny efekt można również zaobserwować w przypadku elementów bloku p z okresu 4. Tym razem efekt słabego ekranowania orbitali d, które wypełniają się podczas przechodzenia przez okresy metali przejściowych..
Przykłady
Dla okresu 2 układu okresowego promienie atomowe jego pierwiastków wynoszą:
-Li: 257 wieczorem
-Be: 112 pm
-B: 88 po południu
-C: 77 wieczorem
-N: 74 po południu
-Lub: 66 wieczorem
-F: 64 po południu
Zauważ, że lit metaliczny ma największy promień atomowy (257 pm), podczas gdy fluor, znajdujący się po prawej stronie okresu, jest najmniejszy z nich wszystkich (64 pm). Promień atomowy opada od lewej do prawej w tym samym okresie, a wymienione wartości to pokazują.
Lit podczas tworzenia wiązań metalicznych ma promień metaliczny; i fluoru, ponieważ tworzy wiązania kowalencyjne (F-F), jego promień jest kowalencyjny.
A co jeśli chcesz wyrazić promienie atomowe w jednostkach angstremów? Po prostu podziel je przez 100: (257/100) = 2,57Å. I tak dalej z pozostałymi wartościami.
Bibliografia
- Chemistry 301. Atomic Radii. Odzyskany z: ch301.cm.utexas.edu
- Fundacja CK-12. (28 czerwca 2016). Promień atomowy. Źródło: chem.libretexts.org
- Trendy w Atomic Radii. Zaczerpnięte z: intro.chem.okstate.edu
- Clackamas Community College. (2002). Rozmiar atomowy. Odzyskany z: dl.clackamas.edu
- Clark J. (sierpień 2012). Promień atomowy i jonowy. Źródło: chemguide.co.uk
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Wydanie czwarte, str. 23, 24, 80, 169). Mc Graw Hill.


Jeszcze bez komentarzy