
Aromatyczne efekty substytucji nukleofilowej, przykłady
Plik aromatyczna substytucja nukleofilowa (SNAr) to reakcja zachodząca w chemii organicznej, polegająca na zastąpieniu dobrej grupy opuszczającej przez nadchodzącego nukleofila. Z punktu widzenia jej mechanizmu i aspektów elektronicznych jest to przeciwna strona elektrofilowej substytucji aromatycznej (SEAr).
Na ogół grupą opuszczającą jest halogen, który występuje jako anion halogenkowy X-. Ta reakcja może mieć miejsce tylko wtedy, gdy pierścień aromatyczny (głównie benzen) ma niedobór elektronów; to znaczy, jeśli ma odciągające elektrony grupy podstawnikowe.

Górny obraz przedstawia to, co zostało powiedziane w poprzednim akapicie. Grupa atraktorów elektronów EWG (od angielskiego akronimu: Grupa wycofująca elektrony) aktywuje pierścień aromatyczny do ataku nukleofilowego negatywnego gatunku Nu-. Można zauważyć, że tworzy się półprodukt (w środku), z którego jest uwalniany lub wydostaje się halogenek X-.
Zauważ, że w prostych słowach X zastępuje Nu w pierścieniu aromatycznym. Ta reakcja jest bardzo wszechstronna i niezbędna w syntezie nowych leków, a także w badaniach syntetycznej chemii organicznej..
Indeks artykułów
- 1 Aspekty ogólne
- 1.1 Różnice w stosunku do elektrofilowej substytucji aromatycznej
- 2 Efekty
- 2.1 Liczby podstawników
- 2.2 Od grupy opuszczającej
- 3 Przykład
- 3.1 Uwagi końcowe
- 4 Odnośniki
Główne cechy
Pierścień aromatyczny może być „naładowany” lub „wyładowany” elektronów w zależności od tego, jakie są jego podstawniki (te, które zastępują oryginalne wiązanie C-H).
Kiedy te podstawniki mogą przekazać pierścieniowi gęstość elektronów, mówi się, że wzbogacają go w elektrony; Jeśli wręcz przeciwnie, są atraktorami o gęstości elektronowej (wspomniana wyżej EWG), to mówi się, że zubażają pierścień elektronów.
W każdym przypadku pierścień jest aktywowany dla określonej reakcji aromatycznej, podczas gdy jest dezaktywowany dla drugiego..
Na przykład, mówi się, że bogaty w elektrony pierścień aromatyczny jest aktywny w przypadku elektrofilowego podstawienia aromatycznego; to znaczy, może przekazać swoje elektrony gatunkowi elektrofilowemu, E.+. Jednak nie przekaże elektronów gatunkowi Nu-, ponieważ ładunki ujemne odpychałyby się nawzajem.
Otóż, jeśli pierścień jest ubogi w elektrony, nie ma możliwości przekazania ich gatunkowi E.+ (SEAr nie występuje); z drugiej strony ma możliwość przyjmowania elektronów gatunku Nu- (opracowano SNAr).
Różnice z aromatyczną substytucją elektrofilową
Po wyjaśnieniu ogólnych aspektów danych wejściowych można teraz wymienić niektóre różnice między SNAr a SEAr:
- Pierścień aromatyczny działa jak elektrofil (z niedoborem elektronów) i jest atakowany przez nukleofil.
- Grupa opuszczająca X jest podstawiona na pierścieniu; nie H+
- Nie powstają karbokationy, ale pośrednicy z ładunkiem ujemnym, który może zostać zdelokalizowany przez rezonans
- Obecność większej liczby grup atraktorów w pierścieniu przyspiesza substytucję zamiast ją spowalniać
- Wreszcie, grupy te nie mają wpływu na to, gdzie (na którym węglu) nastąpi podstawienie. Podstawienie zawsze będzie następowało na węglu przyłączonym do grupy opuszczającej X.
Ostatni punkt jest również zilustrowany na rysunku: wiązanie C-X pęka, tworząc nowe wiązanie C-Nu.
Efekty Edytuj
Liczba podstawników
Oczywiście im bardziej ubogi w elektrony pierścień, tym szybsze rSNA i mniej drastyczne warunki wymagane do jego wystąpienia. Rozważmy następujący przykład przedstawiony na poniższym obrazku:
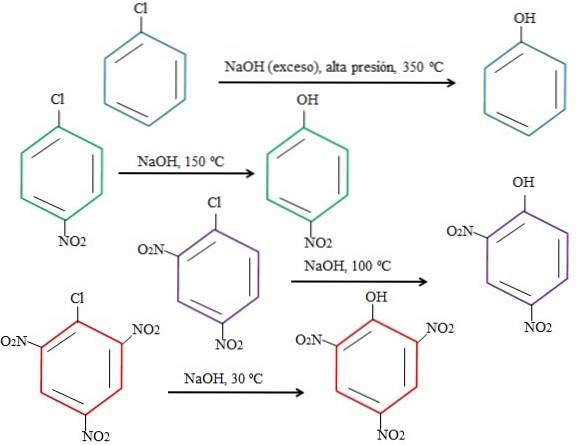
Należy zauważyć, że 4-nitrochlorobenzen (niebieski pierścień) wymaga drastycznych warunków (wysokie ciśnienie i temperatura 350 ° C), aby nastąpiło zastąpienie Cl przez OH. W tym przypadku chlor jest grupą opuszczającą (Cl-) i wodorotlenić nukleofil (OH-).
Kiedy pojawi się grupa NIEdwa, który jest atraktorem elektronów (zielony pierścień), podstawienie można przeprowadzić w temperaturze 150 ° C pod ciśnieniem otoczenia. Wraz ze wzrostem liczby grup NOdwa obecna (fioletowe i czerwone pierścienie), podstawienie odbywa się w niższych i niższych temperaturach (odpowiednio 100ºC i 30ºC).
Dlatego grupy NIE sądwa przyspieszyć rSNA i pozbawić pierścień elektronów, czyniąc go bardziej podatnym na atak OH-.
Względne pozycje Cl względem NO nie będą tutaj wyjaśnione.dwa w 4-nitrochlorobenzenie i jak zmieniają one szybkość reakcji; Na przykład szybkości reakcji 2-nitrochlorobenzenu i 3-nitrochlorobenzenu są różne, przy czym ten ostatni jest najwolniejszy w porównaniu z innymi izomerami.
Z grupy wychodzącej
Odzyskując 4-nitrochlorobenzen, jego reakcja podstawienia przebiega wolniej w porównaniu z jego fluorowanym odpowiednikiem:
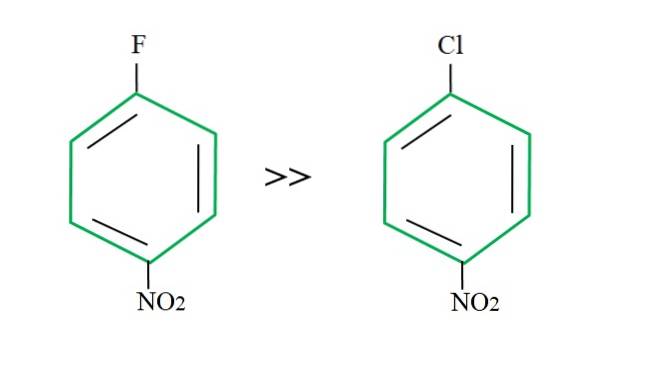
Wyjaśnienie tego nie może leżeć w żadnej innej zmiennej niż różnica między F i Cl. Fluor jest straszną grupą opuszczającą, ponieważ wiązanie C-F jest trudniejsze do zerwania niż wiązanie C-Cl. Dlatego zerwanie tego wiązania nie jest decydującym krokiem prędkości dla SNAr, ale dodaniem Nu- do pierścienia aromatycznego.
Ponieważ fluor jest bardziej elektroujemny niż chlor, atom węgla z nim związany ma większy niedobór elektroniki (C.δ+-faδ-). W konsekwencji węgiel wiązania C-F jest znacznie bardziej podatny na atak Nu- niż wiązanie C-Cl. Dlatego podstawienie F za OH jest znacznie szybsze niż Cl za OH.
Przykład
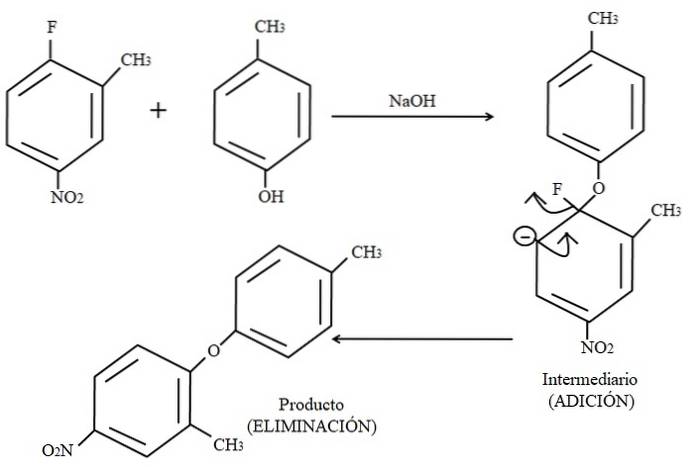
Wreszcie przykład tego typu reakcji organicznych pokazano poniżej na powyższym obrazku. Wydaje się, że para-krezol nie jest nukleofilem; ale ponieważ istnieje podłoże podstawowe, jego grupa OH jest deprotonowana, pozostawiając ją jako anion fenoksydowy, który atakuje 2-metylo-4-nitrofluorobenzen.
Kiedy następuje ten atak, mówi się, że nukleofil dodaje się do elektrofilu (pierścień aromatyczny 2-metylo-4-nitrofluorobenzenu). Ten etap można zobaczyć po prawej stronie obrazu, na którym powstaje związek pośredni z obydwoma podstawnikami należącymi do pierścienia.
Po dodaniu para-krezolu pojawia się ładunek ujemny, który jest zdelokalizowany przez rezonans w pierścieniu (zauważ, że przestaje być aromatyczny).
Na zdjęciu pokazana jest tylko ostatnia struktura rezonansowa, z której fluor kończy się jako F.-; ale w rzeczywistości wspomniany ładunek ujemny zostaje zdelokalizowany nawet w atomach tlenu grupy NOdwa. Po etapie dodawania następuje etap eliminacji, ostatni, w którym produkt jest ostatecznie formowany.
Komentarz końcowy
Grupa NIEdwa pozostałość można zredukować do grupy NHdwa, a stamtąd można przeprowadzić więcej reakcji syntezy w celu zmodyfikowania końcowej cząsteczki. Podkreśla to syntetyczny potencjał rSNA i że jego mechanizm również składa się z dwóch etapów: jednego do dodawania i drugiego do eliminacji..
Obecnie jednak istnieją eksperymentalne i obliczeniowe dowody na to, że reakcja faktycznie przebiega zgodnie z uzgodnionym mechanizmem, w którym oba etapy zachodzą jednocześnie w aktywowanym kompleksie, a nie w związku pośrednim..
Bibliografia
- Morrison, R. T. i Boyd, R, N. (1987). Chemia organiczna. Wydanie 5. Od redakcji Addison-Wesley Interamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Wikipedia. (2019). Substytucja nukleofilowa aromatyczna. Odzyskane z: en.wikipedia.org
- James Ashenhurst. (06 września 2019). Nukleofilowa substytucja aromatyczna (NAS). Odzyskane z: masterorganicchemistry.com
- Chemia LibreTexts. (05 czerwca 2019). Nukleofilowa substytucja aromatyczna. Źródło: chem.libretexts.org



Jeszcze bez komentarzy