
Uzasadnienie i techniki barwienia kapsułek

Plik barwienie kapsułek to technika barwienia różnicowego, która ma właściwość uwydatniania struktury polisacharydu otaczającej niektóre bakterie i drożdże zwane kapsułką. Jest stosowany w laboratoriach klinicznych, aby pomóc w diagnozowaniu niektórych patologii wywoływanych przez mikroorganizmy otoczkowe..
Jest również wykorzystywany w laboratoriach dydaktycznych do demonstrowania tej struktury morfologicznej studentom kierunków medycznych, takich jak m.in. medycyna, bioanaliza, pielęgniarstwo czy cytotechnologia..
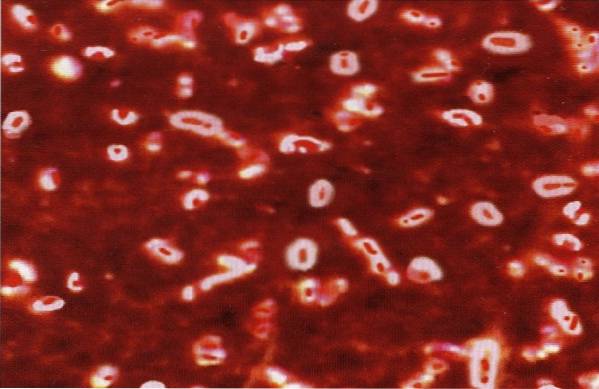
Istnieje kilka prostych technik wykazania obecności kapsułki w mikroorganizmach, które ją posiadają, są to: plama negatywowa, plama Anthony'ego i wariant łączący dwie poprzednie..
Barwienie ujemne jest stosowane głównie w próbkach płynu mózgowo-rdzeniowego, gdy podejrzewa się obecność drożdży. Cryptococcus neoformans. Te drożdże są częstą przyczyną zapalenia opon mózgowych.
Technika ta wykorzystuje nigrozyna lub tusz indyjski i polega na stworzeniu kontrastu między tłem preparatu a nieprzeniknioną otoczką mikroorganizmu. Tło staje się ciemne, a kapsułka jest bezbarwna. W ten sposób ta struktura jest podkreślona.
Jeśli chodzi o technikę Anthony'ego, można powiedzieć, że jest ona najczęściej stosowana w laboratoriach dydaktycznych do zademonstrowania struktury polisacharydów w bakteriach, takich jak Klebsiella pneumoniae, Streptococcus pneumoniae Y Neisseria meningitidis.
Zastosowanie tej techniki do celów diagnostycznych jest bardzo rzadkie, ponieważ istnieją inne rutynowe testy, które pozwalają na identyfikację tych mikroorganizmów..
Indeks artykułów
- 1 Uzasadnienie
- 2 Techniki barwienia kapsułek
- 2.1 - Plama Anthony'ego
- 2.2 -Negatywne zabarwienie
- 2.3 -Indyjska technika atramentowa
- 3 Odnośniki
Podstawa
Kapsułka jest silną strukturą o charakterze polisacharydowym. Chroni to mikroorganizmy przed fagocytozą, a zatem jest strukturą trudną do penetracji.
Dlatego plamy z kapsułek są oparte na kontraście. Barwniki plamią spód preparatu, podczas gdy kapsułka pozostaje bezbarwna.
Dlatego dzięki tym technikom kapsułka jest łatwo rozpoznawalna. Jeśli mikroorganizm nie będzie miał kapsułki, nie da się go rozróżnić przy tego typu zabarwieniu, ponieważ wszystko będzie poplamione tym samym kolorem..
Wszystkie techniki użyte do barwienia kapsułki mają to samo uzasadnienie, pomimo stosowania różnych barwników i procedur..
Techniki dlado barwienia kapsułek
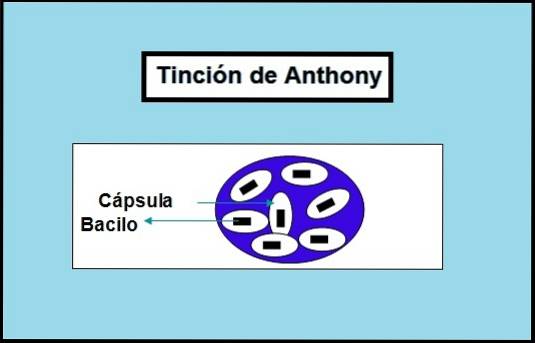
-Plama Anthony'ego
W plamie Anthony'ego zastosowano fiolet krystaliczny jako plamę. Spowoduje to zabarwienie ciała bakterii i tła na fioletowo.
Z drugiej strony stosuje się 20% siarczanu miedzi. Służy jako roztwór myjący, czyli usuwa nadmiar fioletowych kryształów z preparatu, sprawiając, że kapsułki stają się przezroczyste, ale bez utraty koloru ciała bakterii ani tła..
Materiały
- Opalizujące mleko.
- Slajd mikroskopowy.
- 1% Fioletowego Kryształu.
- 20% siarczanu miedzi.
- Mikroskop optyczny.
- Olejek immersyjny.
Proces
Ta technika składa się z:
- Hoduj mikroorganizm w opalizującym mleku przez 36 godzin.
- Umieść kroplę kultury na końcu szkiełka, a obok niej umieść kroplę fioletowego szkła, wymieszaj i rozprowadź końcem kolejnego szkiełka..
- Wysuszyć na powietrzu i nie utwardzać.
- Przemyć 20% roztworem siarczanu miedzi i pozostawić do wyschnięcia.
- Obserwować pod mikroskopem z obiektywem immersyjnym. Szukaj w kierunku końcówek spreadu.
Ważne jest, aby nie używać ciepła ani do utrwalania, ani do suszenia, ponieważ powoduje to uszkodzenie kapsułki. Nie myć również wodą.
Interpretacja
Mleko opalizujące jest doskonałą pożywką hodowlaną, ponieważ dostarcza mikroorganizmowi składników odżywczych niezbędnych do wytworzenia widocznej kapsułki.
Z drugiej strony, opalizujące mleczko utworzy grube i zwarte dno, które wraz z ciałem bakterii będzie zabarwione na fioletowo, ale otoczka otaczająca mikroorganizm pozostanie bezbarwna. Dlatego wokół ciała bakterii obserwuje się wyraźną aureolę..
Korzyść
Jest to prosta technika do wykonania. Nie wymaga mocowania.
Podobnie należy zauważyć, że można stosować inne pożywki hodowlane, ale pożywka mleczna jest preferowana, ponieważ ma tę zaletę, że zapewnia bardziej widoczne kapsułki..
Niedogodności
Jest to technika nieco bardziej pracochłonna niż barwienie negatywowe, a jej wizualizacja wymaga odczekania do całkowitego wyschnięcia preparatu..
-Barwienie negatywne
Materiały
- Szkiełka mikroskopowe.
- Podłoże hodowlane z mikroorganizmem.
- Chiński atrament lub nigrozyna.
- Mikroskop optyczny.
- Fizjologiczny roztwór soli.
Proces
Umieść kroplę soli fizjologicznej na szkiełku nakrywkowym i rozpuść niewielką część kultury drobnoustrojów. Ważne jest, aby preparat nie był zbyt gęsty. Następnie umieść kroplę chińskiego atramentu lub nigrozyny i wymieszaj.
Następnie na preparat umieszcza się arkusz szkiełka nakrywkowego bez przelewania płynu. Obserwuje się go pod mikroskopem, najpierw skupiając się na obiektywie 10X, a następnie przesuwając do 40X.
Technika ta może być również stosowana bezpośrednio na próbkach CSF. Oznacza to, że zamiast umieścić kroplę kultury drobnoustrojów, umieszcza się kroplę płynu mózgowo-rdzeniowego.
Korzyść
Jest to prosta metoda do wykonania i jednocześnie niedroga. Nie wymaga utrwalania ani suszenia preparatu.
Niedogodności
Wadą jest to, że trzeba to obserwować pod mikroskopem, zanim preparat wyschnie, ponieważ w takim przypadku mikroorganizmy będą się kurczyć, co utrudni wizualizację..
Z drugiej strony, fałszywie dodatnie wyniki mogą wystąpić, jeśli analityk jest niedoświadczony, ponieważ leukocyty są często mylone z drożdżami..
Obserwację kapsułek drożdżowych techniką chińskiego tuszu lub nigrozyny należy traktować jako wstępną diagnozę Cryptococcus neoformans dopóki nie zostanie zademonstrowane w kulturze.
Dzieje się tak, ponieważ istnieją inne drożdżaki, które mogą być przyczyną zapalenia opon mózgowych, a nie tylko Cryptococcus neoformans, takie jak gatunki z rodzaju Candida i Rhodotorula, a także inne gatunki Cryptococcus.
Interpretacja
W przypadku mikroorganizmów otoczkowanych, obserwowane będzie ciemne tło z przezroczystymi ciałami unoszącymi się w cieczy, co podkreśla obecność kapsułki..
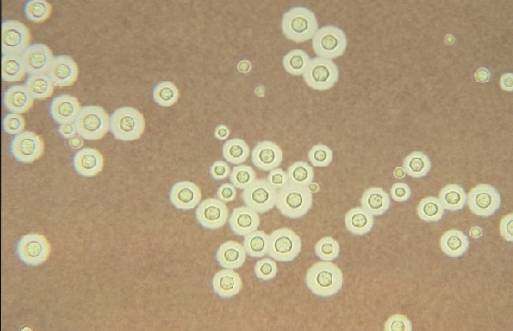
-Technika tuszu indyjskiego
Ta technika może być również wykonana z nigrozyną. Jest to połączenie wcześniej wyjaśnionych technik. Ta technika wykorzystuje fiolet krystaliczny i atrament indyjski lub nigrozynę.
Ciało bakterii zmienia kolor na fioletowy od fioletu krystalicznego, ponieważ jest naładowany ujemnie, podczas gdy nigrozyna zabarwia spód rozmazu. Jeśli bakteria ma otoczkę, pojawi się jako przezroczysta aureola wokół mikroorganizmu..
Fiolet krystaliczny można zastąpić dowolnym z kolorów: safraniną, podstawową fuksyną lub błękitem metylenowym.
Materiały
- Fioletowe szkło.
- Nigrozyna lub tusz indyjski.
- Szkiełka mikroskopowe.
- Mikroskop.
Proces
- Hoduj mikroorganizm w pożywce hodowlanej.
- Umieść kroplę kultury na końcu szkiełka i obok niego, umieść kroplę krystalicznego atramentu indyjskiego lub nigrozyny, wymieszaj i rozprowadź koniec kolejnego szkiełka..
- Wysuszyć na powietrzu i nie nagrzewać.
- Przykryć roztworem fioletu krystalicznego na 1 minutę, przemyć wodą destylowaną, ale bardzo delikatnie (delikatny strumień), pozostawić do wyschnięcia na powietrzu.
- Obserwować pod mikroskopem z obiektywem immersyjnym. Szukaj w kierunku końcówek spreadu.
Interpretacja
Będzie widoczne fioletowe ciało bakterii i ciemne tło. Kapsułka, jeśli jest obecna, będzie wyglądać na bezbarwną wokół bakterii.
Bibliografia
- Covadonga A, Silóniz M, Serrano S. Podstawowe techniki mikrobiologii. Obserwacja bakterii. Reduca (biologia). Seria mikrobiologii. 2010; 3 (5): 15-38. re
- López-Jácome L, Hernández-Durán M, Colín-Castro C, Ortega-Peña S, Cerón-González G, Franco-Cendejas R. Podstawowe barwienia w laboratorium mikrobiologicznym. Mediagraphic.org. 2014; 3 (1): 10-18. Dostępne pod adresem: medigraphic.com
- Gil M. Barwienie negatywne: uzasadnienie, technika, zalety i wady. Lifeder.com.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott Microbiological Diagnosis. 12 ed. Argentyna. Od redakcji Panamericana S.A
- Tankeshwar A. Capsule Stain: Zasada, Procedura i Wyniki. 2019. Poradnik mikrobiologii medycznej. Dostępne w: microbeonline.com


Jeszcze bez komentarzy