
Uzasadnienie, techniki i zastosowania barwienia zarodników

Plik barwienie zarodników Jest to metodologia stosowana do barwienia struktur odpornościowych, które tworzą niektóre rodzaje bakterii, gdy znajdują się one w niekorzystnych warunkach; struktury te odpowiadają formom przetrwania.
Istnieje wiele rodzajów, które tworzą zarodniki; jednak głównymi z nich są Bacillus i Clostridium. Te rodzaje są uważane za bardziej odpowiednie, ponieważ zawierają gatunki chorobotwórcze dla ludzi..
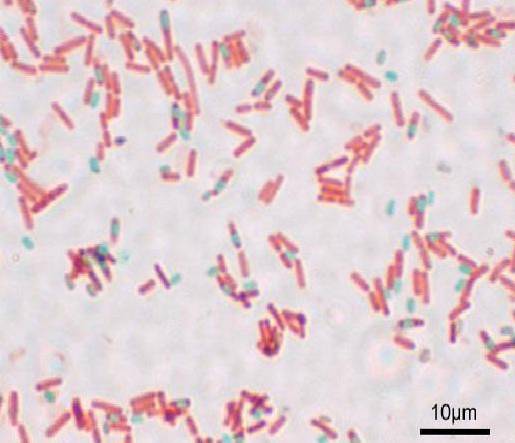
Każdy Bacillus może spowodować powstanie zarodnika. W momencie barwienia preparatu zarodnik można znaleźć w obrębie Bacillus (endospore) lub poza nim (exospore). Przy konwencjonalnych technikach barwienia bakterii - takich jak barwienie Grama - zarodniki pozostają bezbarwne.
Obecnie istnieje kilka metod barwienia, które są zdolne do penetracji grubej struktury zarodnika w celu jego zabarwienia. Te metodologie są bardzo zróżnicowane; Należą do nich technika Dorner, barwienie Möellera i metodologia Shaeffer-Fulton, znana również jako Wirtz-Conklin..
Ze wszystkich wymienionych technik metodologia Shaeffer-Fulton jest najczęściej stosowana w rutynowych laboratoriach. Jej nazwa pochodzi od dwóch mikrobiologów, którzy stworzyli zabarwienie w 1930 roku: Alicii Shaeffer i MacDonalda Fultona. Jednak technika ta jest czasami nazywana Wirtz-Conklin na cześć dwóch bakteriologów z XX wieku..
Indeks artykułów
- 1 Uzasadnienie
- 2 Techniki barwienia zarodników
- 2.1 Technika Dornera
- 2.2 Zmodyfikowana technika Dornera
- 2.3 Technika Shaeffer-Fulton lub Wirtz-Conklin
- 2.4 Technika Möellera
- 2.5 Zmodyfikowana technika Möellera bez ciepła
- 3 Zastosowania
- 3.1 Przykłady
- 4 Odnośniki
Podstawa
Zarodniki nie plamią konwencjonalnymi plamami, ponieważ mają bardzo grubą ścianę. Złożony skład zarodników zapobiega przedostawaniu się większości barwników.
Jeśli zarodnik jest badany z zewnątrz do wewnątrz, obserwuje się następujące warstwy: pierwsza to egzosporium, które jest najcieńszą i zewnętrzną warstwą utworzoną przez glikoproteiny.
Następnie pojawia się naskórek, który zapewnia odporność na wysokie temperatury, a następnie kora zbudowana z peptydoglikanu. Później jest ściana podstawy, która chroni protoplast.
Zarodnik jest odwodnioną strukturą, która zawiera 15% wapnia i kwasu dipikolinowego. Z tego powodu większość technik barwienia zarodników polega na doprowadzeniu ciepła, aby barwnik mógł penetrować grubą strukturę..
Po zabrudzeniu zarodników nie można usunąć barwnika. W technice Shaeffer-Fulton zieleń malachitowa wnika do komórek wegetatywnych, a po zastosowaniu ciepła przenika również przetrwalniki i egzospory..
Przez przemywanie wodą barwnik jest usuwany z komórki wegetatywnej. Dzieje się tak, ponieważ zielony malachitowy barwnik jest lekko zasadowy, więc słabo wiąże się z komórką wegetatywną..
Zamiast tego nie może wydostać się z zarodników, a Bacillus jest ostatecznie barwiony kontrastowo za pomocą safraniny. Ta podstawa jest ważna dla pozostałych technik, w których dzieje się coś podobnego.
Techniki barwienia zarodników
Aby wykonać barwienie zarodników, musisz mieć czystą kulturę podejrzanego szczepu, który chcesz zbadać..
Hodowlę poddaje się działaniu ekstremalnych temperatur przez 24 godziny w celu pobudzenia mikroorganizmu do zarodnikowania. W tym celu hodowlę można umieścić w piecu w 44 ° C lub w lodówce (8 ° C) na 24 lub 48 godzin..
Jeśli pozostawi się je zbyt długo w wymienionych temperaturach, obserwowane będą tylko egzospory, ponieważ wszystkie przetrwalniki opuściły już Bacillus.
Pod koniec tego czasu na czystym szkiełku należy umieścić kilka kropli sterylnego roztworu fizjologicznego. Następnie pobiera się małą porcję kultury i robi się drobną pastę.
Następnie pozostawia się do wyschnięcia, umieszcza w ogniu i barwi jedną z technik opisanych poniżej:
Technika Dornera
1- Przygotuj skoncentrowaną zawiesinę zarodnikującego mikroorganizmu w wodzie destylowanej w probówce i dodaj taką samą objętość przefiltrowanej fuksyny karbolu Kinyoun.
2- Umieść probówkę we wrzącej łaźni wodnej na 5 do 10 minut.
3- Na czystym szkiełku wymieszać kroplę poprzedniej zawiesiny z kroplą 10% wodnego roztworu nigrozyny, ugotować i przefiltrować..
4- Rozprowadzić i szybko wysuszyć z delikatnym ciepłem.
5- Zbadaj obiektywem 100X (zanurzenie).
Zarodniki wybarwiają się na czerwono, a komórki bakterii wydają się prawie bezbarwne na ciemnoszarym tle.
Zmodyfikowana technika Dornera
1- Zawiesinę zarodnikującego mikroorganizmu rozprowadza się na szkiełku i utrwala w cieple.
2- Próbkę przykrywa się paskiem bibuły filtracyjnej, do którego dodaje się fuksynę karbolową. Barwnik jest podgrzewany przez 5 do 7 minut płomieniem palnika Bunsena, aż do wytworzenia się oparów. Następnie papier jest usuwany.
3- Preparat myje się wodą, a następnie suszy bibułą.
4- Przykryj rozmaz cienką warstwą 10% nigrozyny, używając drugiego szkiełka do rozprowadzenia nigrozyny lub igły.
Zabarwienie zarodników i bakterii jest takie samo, jak to opisane w stanie techniki.
Technika Shaeffer-Fulton lub Wirtz-Conklin
1- Wykonać drobny rozmaz zawiesiną zarodnikującego mikroorganizmu na szkiełku i utrwalić na gorąco.
2- Przykryć szkiełko 5% wodnym roztworem zieleni malachitowej (na szkiełku można umieścić bibułę filtracyjną).
3- Podgrzać nad płomieniem palnika Bunsena, aby spowodować uwolnienie oparów i usunąć płomień. Powtórz operację przez 6 do 10 minut. Jeśli roztwór zieleni malachitowej wyparuje zbyt mocno podczas zabiegu, więcej.
4- Wyjmij papier filtracyjny (jeśli jest zainstalowany) i umyj go wodą.
5- Przykryć szkiełko 0,5% wodną safraniną na 30 sekund (niektóre warianty techniki wykorzystują 0,1% wodną safraninę i pozostawić na 3 minuty).
Dzięki tej technice zarodniki wydają się zielone, a pałeczki czerwone..
Wadą jest to, że przetrwalniki młodych kultur nie wybarwiają się dobrze, ponieważ wydają się wyjątkowo przezroczyste lub bezbarwne. Aby tego uniknąć, zaleca się stosowanie kultur inkubowanych przez 48 godzin..
Technika Möellera
1- Przykryj rozmaz chloroformem na 2 minuty.
2- Wyrzucić chloroform.
3- Pokryć 5% kwasem chromowym na 5 minut.
4- Umyć wodą destylowaną
5- Arkusz jest pokryty fuksynem karbolowym i wystawiony na działanie płomienia palnika Bunsena do momentu wydzielenia się oparów; następnie jest usuwany z płomienia na kilka chwil. Operację powtarza się do zakończenia 10 minut.
6- Umyć wodą.
7- Użyj zakwaszonego etanolu (alkohol solny), aby odbarwić. Pozostaw na 20 lub 30 sekund.
8- Umyć wodą destylowaną.
9- Kontrastinuj, przykrywając arkusz błękitem metylenowym przez 5 minut.
10- Umyć wodą destylowaną.
11- Pozostaw do wyschnięcia i przenieś próbkę do mikroskopu.
Zarodniki są czerwone, a laseczki niebieskie. Ważne jest, aby nie wdychać oparów, ponieważ są one toksyczne i na dłuższą metę mogą być rakotwórcze..
Zmodyfikowana bez ogrzewania technika Möellera
W 2007 Hayama i jego współpracownicy stworzyli modyfikację techniki Möellera. Wyeliminowali etap podgrzewania barwnika i zastąpili go dodając 2 krople środka powierzchniowo czynnego Tergitol 7 na każde 10 ml roztworu fuksyna karbol-karbol. Uzyskano takie same wyniki.
Aplikacje
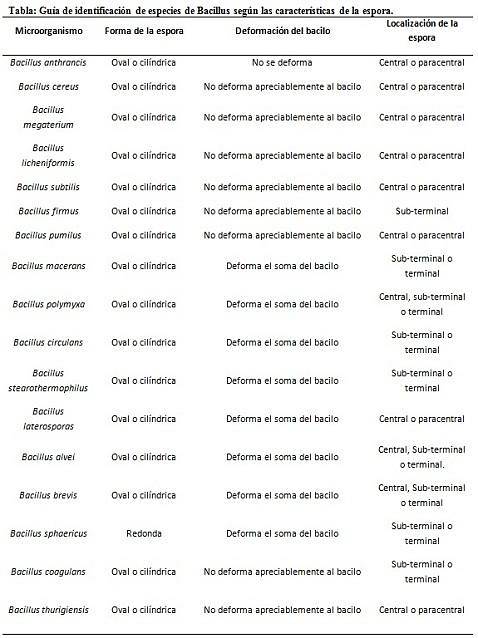
Barwienie zarodników dostarcza bardzo cennych i użytecznych informacji do identyfikacji patogenu, ponieważ jego obecność, kształt, umiejscowienie w obrębie pałeczki i zdolność do deformacji komórki wegetatywnej, czy też nie, to dane, które mogą wskazywać na gatunek zaangażowany w określony gatunek.
W tym kontekście warto powiedzieć, że zarodniki mogą być okrągłe lub owalne, mogą znajdować się w centrum lub też w pozycji paracentralnej, podminalnej lub końcowej..
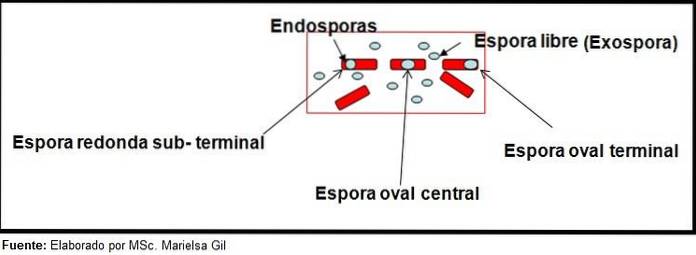
Przykłady
- Clostridium difficile tworzy owalny zarodnik w pozycji końcowej, który deformuje pałeczkę.
- Zarodnik Clostridium tert jest owalny, nie deformuje pałeczki i znajduje się na poziomie terminala.
- Endospora Clostridium tetani jest nieuleczalna i deformuje pałeczkę, nadając jej wygląd podudzia.
- Zarodniki Clostridium botulinum, do. histolyticum, do. nowy Y C. septicum są okrągłe lub owalne subterminal i deformują pałeczkę.
- Endospora Clostridium sordelli znajduje się w pozycji centralnej, z lekkim odkształceniem.
Bibliografia
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Propozycja uproszczonej techniki barwienia przetrwalników bakterii bez stosowania udanej termicznie modyfikacji metody Moellera. Eur J Med Res.2007; 16 12 (8): 356–9.
- Współtwórcy Wikipedii. Bejca Moellera. Wikipedia, wolna encyklopedia. 3 listopada 2018, 03:28 UTC. Dostępne pod adresem: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Podręcznik technik mikrobiologicznych. Katedra Nauk Podstawowych Akademii Mikrobiologii. Narodowy Instytut Politechniczny.
- "Endospora." Wikipedia, wolna encyklopedia. 25 lutego 2018 r., 10:20 UTC. 10 stycznia 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J i współpracownicy. (2006). Personel autonomicznej wspólnoty Estremadury. Szczegółowy porządek obrad Tom IV. MAD Editorial. Sewilla-Hiszpania, str. 211–212.
- Silva M, García M, Corrales J, Ponce E. (2006), Technik specjalista laboratoryjny, Galicyjska służba zdrowia (SERGAS). Tematyka agendy tematycznej tom 2. Od redakcji MAD. Sewilla-Hiszpania, str. 79–80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnoza mikrobiologiczna. (Wyd. 5). Argentyna, od redakcji Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott Microbiological Diagnosis. 12 ed. Argentyna. Od redakcji Panamericana S.A



Jeszcze bez komentarzy