
Mechanizm, funkcja i przykłady transaminacji
Plik transaminacja jest rodzajem reakcji chemicznej, która działa na zasadzie „redystrybucji” grup aminowych między aminokwasami, ponieważ obejmuje odwracalne procesy aminowania (dodanie grupy aminowej) i deaminację (eliminację grupy aminowej), które są katalizowane przez określone znane enzymy jako transaminazy lub aminotransferazy.
Ogólna reakcja transaminacji obejmuje wymianę między aminokwasem a jakimkolwiek α-ketokwasem, gdzie wymiana grupy aminowej daje wersję ketokwasową pierwszego substratu aminokwasu i wersję aminokwasową pierwszego substratu α-ketokwasu..

Grupa aminowa, która jest zwykle wymieniana, to grupa aminowa „alfa”, to znaczy ta, która uczestniczy w tworzeniu wiązań peptydowych i określa strukturę aminokwasów, chociaż mogą również zachodzić reakcje z udziałem innych grup aminowych obecnych w różnych pozycjach..
Z wyjątkiem lizyny, treoniny, proliny i hydroksyproliny, wszystkie aminokwasy biorą udział w reakcjach transaminacji, chociaż transaminazy zostały opisane dla histydyny, seryny, metioniny i fenyloalaniny, ale ich szlaki metaboliczne nie obejmują tego typu reakcji..
Reakcje transaminacji między aminokwasami i α-ketokwasami zostały odkryte w 1937 roku przez Braunsteina i Kritzmanna i od tego czasu są przedmiotem intensywnych badań, gdyż występują w wielu tkankach różnych organizmów i mają różne przeznaczenie..
Na przykład u ludzi transaminazy są szeroko rozpowszechnione w tkankach organizmu i są szczególnie aktywne w tkance mięśnia sercowego, wątrobie, tkance mięśni szkieletowych i nerkach..
Indeks artykułów
- 1 Mechanizm reakcji
- 2 Funkcja transaminacji
- 3 przykłady
- 4 Odnośniki
Mechanizm reakcji
Reakcje transaminacji obejmują mniej więcej ten sam mechanizm. Jak omówiono powyżej, reakcje te zachodzą jako odwracalna wymiana grupy aminowej między aminokwasem a α-ketokwasem (deaminowanym), z wytworzeniem α-ketokwasu aminokwasu donorowego i aminokwasu α-ketokwasu chwytnik..
Reakcje te zależą od związku znanego jako fosforan pirydoksalu, pochodnej witaminy B6, która uczestniczy jako transporter grup aminowych i wiąże się z enzymami transaminaz poprzez tworzenie zasady Schiffa między grupą aldehydową tej cząsteczki a grupą ε-aminową reszty lizyny w miejscu aktywnym enzymu.
Wiązanie między fosforanem pirydoksalu a resztą lizyny w miejscu aktywnym nie jest kowalencyjne, ale zachodzi poprzez elektrostatyczne oddziaływanie między dodatnim ładunkiem azotu na lizynie a ujemnym ładunkiem na grupie fosforanowej pirydoksalu.
W trakcie reakcji aminokwas pełniący funkcję substratu wypiera grupę ε-aminową reszty lizyny w miejscu aktywnym uczestniczącym w zasadzie Schiffa z pirydoksalem.
W międzyczasie para elektronów z węgla alfa aminokwasu jest usuwana i przenoszona do pierścienia pirydynowego tworzącego fosforan pirydoksalu (naładowany dodatnio), a następnie „dostarczany” do α-ketokwasu, który działa jako drugi substrat..
W ten sposób fosforan pirydoksalu nie tylko uczestniczy w przenoszeniu lub transporcie grup aminowych pomiędzy aminokwasami a α-ketokwasami, które są substratami transaminaz, ale działa również jako „pochłaniacz” elektronów, ułatwiając dysocjację wodoru alfa aminokwasu..
Podsumowując, pierwszy substrat, aminokwas, przenosi swoją grupę aminową do fosforanu pirydoksalu, skąd jest następnie przenoszony do drugiego substratu, a-ketokwasu, tworząc w międzyczasie związek pośredni znany jako fosforan pirydoksaminy..
Funkcja transaminacji
Enzymy transaminazy znajdują się na ogół w cytozolu i mitochondriach i biorą udział w integracji różnych szlaków metabolicznych.
Dehydrogenaza glutaminianowa w swojej reakcji odwrotnej, na przykład, może przekształcić glutaminian w amon, NADH (lub NADPH) i α-ketoglutaran, który może wejść w cykl kwasu trikarboksylowego i działać w produkcji energii.
Ten enzym, który znajduje się w macierzy mitochondrialnej, stanowi punkt rozgałęzienia, który łączy aminokwasy z metabolizmem energetycznym, tak że gdy komórce brakuje energii w postaci węglowodanów lub tłuszczów do funkcjonowania, może alternatywnie używać niektórych aminokwasów do tego samego cel, powód.
Tworzenie enzymu (dehydrogenazy glutaminianowej) podczas rozwoju mózgu ma zasadnicze znaczenie dla kontroli detoksykacji amonu, ponieważ wykazano, że niektóre przypadki upośledzenia umysłowego mają związek z jego niską aktywnością, co prowadzi do nagromadzenia amoniaku, co jest szkodliwe dla zdrowia mózgu.
W niektórych komórkach wątroby reakcje transaminacji można również wykorzystać do syntezy glukozy na drodze glukoneogenezy.
Glutamina jest przekształcana do glutaminianu i amonu przez enzym glutaminazę. Glutaminian jest następnie przekształcany w α-ketoglutaran, który wchodzi w cykl Krebsa, a następnie do glukoneogenezy. Ten ostatni krok następuje dzięki temu, że jabłczan, jeden z produktów szlaku, jest transportowany z mitochondriów za pomocą wahadłowca..
Ten wahadłowiec pozostawia α-ketoglutaran na łasce enzymu jabłczanowego, który przekształca go w pirogronian. Dwie cząsteczki pirogronianu można następnie przekształcić w jedną cząsteczkę glukozy poprzez glukoneogenezę..
Przykłady
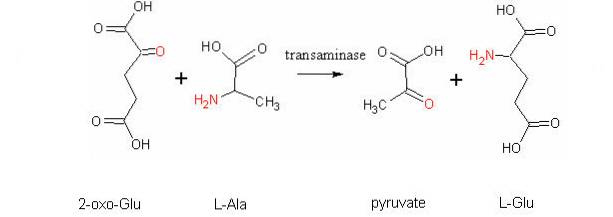
Najczęstsze reakcje transaminacji dotyczą aminokwasów alaniny, kwasu glutaminowego i kwasu asparaginowego..
Niektóre enzymy aminotransferaz, oprócz fosforanu pirydoksalu, mogą wykorzystywać pirogronian jako „koenzym”, taki jak transaminaza glutaminianowo-pirogronianowa, która katalizuje następującą reakcję:
glutaminian + pirogronian ↔ alanina + α-ketoglutaran
W zależności od tej reakcji komórki mięśniowe wytwarzają alaninę z pirogronianu i pozyskują energię poprzez cykl Krebsa poprzez α-ketoglutaran. W tych komórkach wykorzystanie alaniny jako źródła energii zależy od eliminacji grup aminowych, takich jak jony amonowe, w wątrobie, poprzez cykl mocznikowy..
Inną bardzo ważną reakcją transaminacji u różnych gatunków jest ta katalizowana przez enzym aminotransferazę asparaginianową:
L-asparaginian + α-ketoglutaran ↔ szczawiooctan + L-glutaminian
Wreszcie reakcja transaminacji kwasu γ-aminomasłowego (GABA), niebiałkowego aminokwasu niezbędnego dla ośrodkowego układu nerwowego, który działa jako hamujący neuroprzekaźnik. Reakcja jest katalizowana przez transaminazę kwasu γ-aminomasłowego i przebiega z grubsza następująco:
α-ketoglutaran + kwas 4-aminobutanowy ↔ Glutaminian + semialdehyd bursztynowy
Semialdehyd bursztynowy przekształca się w kwas bursztynowy w wyniku reakcji utleniania, który może wejść do cyklu Krebsa w celu produkcji energii.
Bibliografia
- Bhagavan, N. V. i Ha, C. E. (2002). Metabolizm białek i aminokwasów. Medical Biochemistry (4. wyd.), Academic Press: San Diego, CA, USA, 331.
- Cammarata, P. S. i Cohen, P. P. (1950). Zakres reakcji transaminacji w tkankach zwierzęcych. Journal of Biological Chemistry, 187, 439–452.
- Ha, C. E. i Bhagavan, N. V (2011). Podstawy biochemii medycznej: z przypadkami klinicznymi. Academic Press.
- Litwack, G. (2017). Biochemia człowieka. Academic Press.
- Rowsell, E. V. (1956). Transaminacje pirogronianem i innymi α-ketokwasami. Biochemical Journal, 64 (2), 246.
- Snell, E. E. i Jenkins, W. T. (1959). Mechanizm reakcji transaminacji. Journal of cellular and Comparative physiology, 54 (S1), 161-177.



Jeszcze bez komentarzy