
Struktura, właściwości, zastosowania i zagrożenia trietyloaminy
Plik trietyloamina to związek organiczny, a dokładniej amina alifatyczna, której wzór chemiczny to N (CHdwaCH3)3 lub NEt3. Podobnie jak inne ciekłe aminy ma zapach podobny do zapachu amoniaku zmieszanego z rybami; jego opary powodują, że obchodzenie się z tą substancją bez wyciągu lub odpowiedniego ubrania jest uciążliwe i niebezpieczne.
Oprócz odpowiednich formuł, związek ten jest często określany skrótem TEA; może to jednak prowadzić do pomylenia z innymi aminami, takimi jak trietanoloamina, N (EtOH)3, lub tetraetyloamoniowa, czwartorzędowa amina, NEt4+.

Na podstawie jego szkieletu (górne zdjęcie) można powiedzieć, że trietyloamina jest dość podobna do amoniaku; podczas gdy drugi ma trzy atomy wodoru, NH3, pierwsza ma trzy grupy etylowe, N (CHdwaCH3)3. Jego synteza rozpoczyna się od obróbki ciekłego amoniaku etanolem, po czym następuje alkilacja.
Sieć3 może tworzyć higroskopijną sól z HCl: chlorowodorek trietyloaminy, NEt3· HCl. Ponadto uczestniczy jako homogeniczny katalizator w syntezie estrów i amidów, dzięki czemu jest niezbędnym rozpuszczalnikiem w laboratoriach organicznych..
Ponadto, razem z innymi odczynnikami, umożliwia utlenianie alkoholi pierwszorzędowych i drugorzędowych odpowiednio do aldehydów i ketonów. Podobnie jak amoniak jest zasadą i dlatego może tworzyć sole organiczne poprzez reakcje neutralizacji.
Indeks artykułów
- 1 Struktura trietyloaminy
- 2 Właściwości
- 2.1 Wygląd fizyczny
- 2.2 Masa molowa
- 2.3 Temperatura wrzenia
- 2.4 Temperatura topnienia
- 2.5 Gęstość
- 2.6 Rozpuszczalność
- 2.7 Gęstość par
- 2.8 Prężność par
- 2.9 Stała Henry'ego
- 2.10 Temperatura zapłonu
- 2.11 Temperatura samozapłonu
- 2.12 Pojemność cieplna
- 2.13 Ciepło spalania
- 2.14 Ciepło parowania
- 2.15 Napięcie powierzchniowe
- 2.16 Współczynnik załamania światła
- 2.17 Lepkość
- 2.18 Stała zasadowości
- 2.19 Podstawowość
- 3 Zastosowania
- 3.1 Polimery
- 3.2 Chromatografia
- 3.3 Produkty komercyjne
- 4 Ryzyka
- 5 Referencje
Struktura trietyloaminy
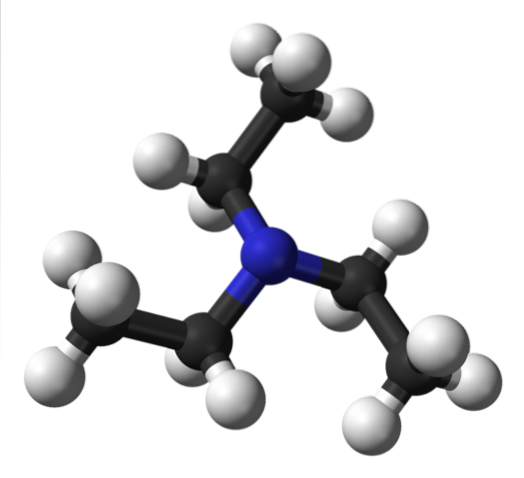
Górny obraz przedstawia strukturę trietyloaminy z modelem kulek i słupków. W środku cząsteczki znajduje się atom azotu, reprezentowany przez niebieskawą kulę; i połączone z nią trzy grupy etylowe, jak małe gałęzie czarnych i białych kulek.
Chociaż nie są one widoczne gołym okiem, na atomie azotu znajduje się para niewspółdzielonych elektronów. Te dwa elektrony i trzy grupy -CHdwaCH3 doświadczają odpychania elektronicznego; ale z drugiej strony przyczyniają się do określenia momentu dipolowego cząsteczki.
Jednak taki moment dipolowy jest mniejszy niż np. Dietyloaminy, NHEtdwa; i podobnie nie ma żadnej możliwości tworzenia wiązań wodorowych.
Dzieje się tak, ponieważ w trietyloaminie nie ma wiązania N-H, a co za tym idzie, obserwuje się niższe temperatury topnienia i wrzenia w porównaniu z innymi aminami, które oddziałują w ten sposób..
Chociaż występuje niewielki moment dipolowy, nie można wykluczyć sił dyspersji między grupami etylowymi cząsteczek NEt.3 sąsiadów. Podsumowując ten efekt, można uzasadnić, dlaczego, chociaż trietyloamina jest lotna, to dzięki swojej stosunkowo dużej masie cząsteczkowej wrze w temperaturze około 89ºC..
Nieruchomości
Wygląd fizyczny
Bezbarwna ciecz o nieprzyjemnym zapachu amoniaku i ryb.
Masa cząsteczkowa
101,193 g / mol.
Temperatura wrzenia
89ºC.
Temperatura topnienia
-115 ° C Zwróć uwagę, jak słabe są siły międzycząsteczkowe, które wiążą cząsteczki trietyloaminy w ich ciele stałym.
Gęstość
0,7255 g / ml.
Rozpuszczalność
Jest stosunkowo rozpuszczalny w wodzie, 5,5 g / 100 g w temperaturze 20ºC. Poniżej 18,7 ° C, według Pubchem, jest nawet z tym mieszalny.
Oprócz „dobrego kontaktu” z wodą jest również rozpuszczalny w acetonie, benzenie, etanolu, eterze i parafinie..
Gęstość pary
3,49 w stosunku powietrza.
Ciśnienie pary
57,07 mmHg w 25ºC.
Henry jest stała
66 μmol / Pa Kg.
punkt zapłonu
-15ºC.
Temperatura samozapłonu
312ºC.
Pojemność cieplna
216,43 kJ / mol.
Ciepło spalania
10248 kcal / g.
Ciepło parowania
34,84 kJ / mol.
Napięcie powierzchniowe
20,22 N / m w 25 ° C.
Współczynnik załamania światła
1400 w 20ºC.
Lepkość
0,347 mPa · s przy 25ºC.
Stała zasadowości
Trietyloamina ma pKb równe 3,25.
Zasadowość
Zasadowość tej aminy można wyrazić następującym równaniem chemicznym:
Netto3 + HA <=> NHEt3+ + DO-
Gdzie HA jest gatunkiem słabo kwaśnym. Para NHEt3+DO- tworzy trzeciorzędową sól amonową.
Sprzężony kwas NHEt3+ jest bardziej stabilny niż amon, NH4+, ponieważ trzy grupy etylowe przekazują część swojej gęstości elektronowej, aby zmniejszyć dodatni ładunek na atomie azotu; dlatego trietyloamina jest bardziej zasadowa niż amoniak (ale mniej zasadowa niż OH-).
Aplikacje

Zasadowość, w tym przypadku nukleofilowość trietyloaminy, służy do katalizowania syntezy estru i amidów ze wspólnego substratu: chlorku acylu, RCOCl (górne zdjęcie).
Tutaj wolna para elektronów z azotu atakuje grupę karbonylową, tworząc związek pośredni; który kolejno jest atakowany przez alkohol lub aminę z utworzeniem, odpowiednio, estru lub amidu.
W pierwszym rzędzie obrazu wizualizowany jest mechanizm, po którym następuje reakcja w celu wytworzenia estru, natomiast w drugim rzędzie przedstawiono amid. Należy zauważyć, że chlorowodorek trietyloaminy, NEt, jest wytwarzany w obu reakcjach3HCl, z którego odzyskuje się katalizator, aby rozpocząć kolejny cykl.
Polimery
Nukleofilowość trietyloaminy jest również wykorzystywana do dodawania do niektórych polimerów, utwardzania ich i nadawania im większej masy. Na przykład jest częścią syntezy żywic poliwęglanowych, pianek poliuretanowych i żywic epoksydowych.
Chromatografia
Jego odległa amfifilowość i lotność pozwalają na stosowanie jego pochodnych soli jako odczynników w chromatografii jonowymiennej. Innym ukrytym zastosowaniem trietyloaminy jest to, że można z niej uzyskać różne sole trzeciorzędowych amin, takie jak wodorowęglan trietyloaminy, NHEt3HCO3 (lub TEAB).
Produkty komercyjne
Jest stosowany jako dodatek do produkcji papierosów i tytoniu, konserwantów żywności, środków do czyszczenia podłóg, aromatów, pestycydów, barwników itp..
Ryzyka
Opary trietyloaminy są nie tylko nieprzyjemne, ale i niebezpieczne, ponieważ mogą podrażniać nos, gardło i płuca, prowadząc do obrzęku płuc lub zapalenia oskrzeli. Podobnie, będąc gęstszymi i cięższymi od powietrza, pozostają na równi z ziemią, przemieszczając się do możliwych źródeł ciepła, aby później eksplodować..
Pojemniki z tym płynem powinny znajdować się jak najdalej od ognia, ponieważ stanowią bezpośrednie zagrożenie wybuchem..
Ponadto należy unikać jego kontaktu z gatunkami lub odczynnikami takimi jak: metale alkaliczne, kwas trichlorooctowy, azotany, kwas azotowy (gdyż tworzyłby nitrozoaminy, związki rakotwórcze), mocne kwasy, nadtlenki i nadmanganiany..
Nie powinien dotykać aluminium, miedzi, cynku ani ich stopów, ponieważ ma zdolność ich korozji.
W przypadku kontaktu fizycznego może powodować alergie i wysypki skórne, jeśli ekspozycja jest ostra. Oprócz płuc może wpływać na wątrobę i nerki. A jeśli chodzi o kontakt z oczami, powoduje podrażnienia, które mogą nawet uszkodzić oczy, jeśli nie są leczone lub czyszczone na czas..
Bibliografia
- Morrison, R. T. and Boyd, R, N. (1987). Chemia organiczna. Wydanie 5. Od redakcji Addison-Wesley Interamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Wikipedia. (2019). Trietyloamina. Odzyskane z: en.wikipedia.org
- Merck. (2019). Trietyloamina. Odzyskany z: sigmaaldrich.com
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Trietyloamina. Baza danych PubChem. CID = 8471. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Sieć danych toksykologicznych. (s.f.). Trietyloamina. Odzyskany z: toxnet.nlm.nih.gov
- Departament Zdrowia stanu New Jersey. (2010). Trietyloamina. Odzyskany z: nj.gov


Jeszcze bez komentarzy