
Konfiguracja i związki wartościowości azotu

Plik wartościowości azotu Wahają się od -3, jak w amoniaku i aminach, do +5, jak w kwasie azotowym (Tyagi, 2009). Ten element nie rozszerza wartościowości, jak inne.
Atom azotu jest pierwiastkiem o liczbie atomowej 7 i pierwszym pierwiastkiem z grupy 15 (dawniej VA) układu okresowego. Grupa składa się z azotu (N), fosforu (P), arsenu (As), antymonu (Sb), bizmutu (Bi) i moskwy (Mc).

Pierwiastki mają pewne ogólne podobieństwa w zachowaniu chemicznym, chociaż wyraźnie różnią się od siebie chemicznie. Te podobieństwa odzwierciedlają wspólne cechy struktur elektronicznych ich atomów (Sanderson, 2016).
Azot jest obecny w prawie wszystkich białkach i odgrywa ważną rolę zarówno w zastosowaniach biochemicznych, jak i przemysłowych. Azot tworzy silne wiązania dzięki swojej zdolności do tworzenia potrójnego wiązania z innym atomem azotu i innymi pierwiastkami..
Dlatego związki azotu zawierają dużą ilość energii. Przed 100 laty niewiele wiedziano o azocie. Teraz azot jest powszechnie używany do konserwowania żywności i jako nawóz (Wandell, 2016).
Konfiguracja elektroniczna i wartościowości
W atomie elektrony wypełniają różne poziomy w zależności od ich energii. Pierwsze elektrony wypełniają niższe poziomy energii, a następnie przechodzą na wyższy poziom energii.
Najbardziej zewnętrzny poziom energii w atomie jest znany jako powłoka walencyjna, a elektrony umieszczone w tej powłoce są znane jako elektrony walencyjne..
Te elektrony występują głównie podczas tworzenia wiązań i reakcji chemicznych z innymi atomami. Dlatego elektrony walencyjne są odpowiedzialne za różne właściwości chemiczne i fizyczne pierwiastka (Valence Electrons, S.F.).
Azot, jak wspomniano wcześniej, ma liczbę atomową Z = 7. Oznacza to, że wypełnienie elektronów w ich poziomach energii lub konfiguracji elektronowej wynosi 1Sdwa 2Sdwa 2 P3.
Należy pamiętać, że w naturze atomy zawsze dążą do uzyskania elektronicznej konfiguracji gazów szlachetnych, poprzez zdobywanie, utratę lub dzielenie się elektronami..
W przypadku azotu szlachetnym gazem, który dąży do uzyskania konfiguracji elektronicznej, jest neon, którego liczba atomowa wynosi Z = 10 (1Sdwa 2Sdwa 2 P6) i hel, którego liczba atomowa wynosi Z = 2 (1Sdwa) (Reusch, 2013).
Różne sposoby łączenia azotu nadają mu wartościowość (lub stopień utlenienia). W szczególnym przypadku azotu, ponieważ znajduje się w drugim okresie układu okresowego, nie jest w stanie rozszerzyć swojej powłoki walencyjnej, jak robią to inne pierwiastki z jego grupy..
Oczekuje się, że będzie miał wartościowości -3, +3 i +5. Jednak azot ma stany walencyjne od -3, jak w amoniaku i aminach, do +5, jak w kwasie azotowym. (Tyagi, 2009).
Teoria wiązań walencyjnych pomaga wyjaśnić powstawanie związków zgodnie z konfiguracją elektronową azotu dla danego stopnia utlenienia. W tym celu należy wziąć pod uwagę liczbę elektronów w powłoce walencyjnej i to, ile pozostało do uzyskania konfiguracji gazu szlachetnego..
Związki azotu
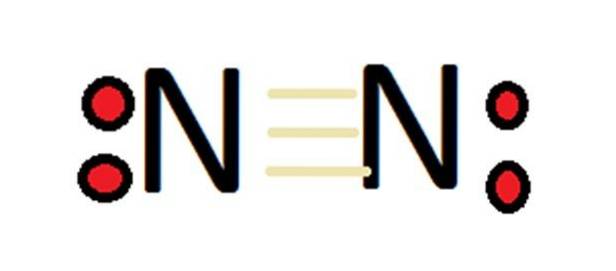
Biorąc pod uwagę dużą liczbę stopni utlenienia, azot może tworzyć wiele związków. W pierwszej kolejności należy pamiętać, że w przypadku azotu cząsteczkowego jego wartościowość z definicji wynosi 0.
Stopień utlenienia -3 jest jednym z najbardziej typowych dla tego pierwiastka. Przykładami związków o tym stopniu utlenienia są amoniak (NH3), aminy (R3N), jon amonowy (NH4+), iminy (C = N-R) i nitryle (C≡N).
Na stopniu utlenienia -2 pozostaje azot z 7 elektronami w powłoce walencyjnej. Ta nieparzysta liczba elektronów w powłoce walencyjnej wyjaśnia, dlaczego związki o tym stopniu utlenienia mają mostkowe wiązanie między dwoma azotami. Przykładami związków o tym stopniu utlenienia są hydrazyny (R.dwa-N-N-Rdwa) i hydrazony (C = N-N-Rdwa).
Na stopniu utlenienia -1 azot pozostaje z 6 elektronami w powłoce walencyjnej. Przykładem związków azotu o tej wartościowości jest hydroksyloamina (R.dwaNOH) i związki azowe (RN = NR).
Na dodatnich stopniach utlenienia azot jest na ogół przyłączany do atomów tlenu, tworząc tlenki, oksysole lub oksykwasy. W przypadku stopnia utlenienia +1 azot ma 4 elektrony w powłoce walencyjnej.
Przykładami związków o tej wartościowości są podtlenek azotu lub gaz rozweselający (NdwaO) i związki nitrozowe (R = NO) (Reusch, Oxidation States of Nitrogen, 2015).
W przypadku stopnia utlenienia +2 przykładem jest tlenek azotu lub tlenek azotu (NO), bezbarwny gaz powstający w wyniku reakcji metali z rozcieńczonym kwasem azotowym. Ten związek jest wyjątkowo niestabilnym wolnym rodnikiem, ponieważ reaguje z Odwa w powietrzu, tworząc gaz NOdwa.
Azotyn (NOdwa-) w roztworze zasadowym i kwasie azotawym (HNOdwa) w roztworze kwaśnym są przykładami związków o stopniu utlenienia +3. Mogą to być środki utleniające normalnie wytwarzające NO (g) lub środki redukujące z wytworzeniem jonu azotanowego..
Trójtlenek diazotu (NdwaLUB3) i grupę nitrową (R-NOdwa) są innymi przykładami związków azotu o wartościowości +3.
Dwutlenek azotu (NOdwa) lub dwutlenek azotu jest związkiem azotu o wartościowości +4. Jest to gaz brunatny generalnie wytwarzany w reakcji stężonego kwasu azotowego z wieloma metalami. Dimeryzuje tworząc N.dwaLUB4.
W stanie +5 znajdziemy azotany i kwas azotowy, które są utleniaczami w kwaśnych roztworach. W tym przypadku azot ma 2 elektrony w powłoce walencyjnej, które znajdują się na orbicie 2S. (Stany utlenienia azotu, S.F.).
Istnieją również związki, takie jak nitrozilazyd i trójtlenek diazotu, w których azot ma różne stopnie utlenienia w cząsteczce. W przypadku nitrosilazydu (N4O) azot ma wartościowość -1, 0, + 1 i +2; aw przypadku trójtlenku diazotu ma wartościowość +2 i +4.
Nazewnictwo związków azotu
Biorąc pod uwagę złożoność chemii związków azotu, tradycyjne nazewnictwo nie wystarczyło, aby je nazwać, a tym bardziej odpowiednio je zidentyfikować. Między innymi dlatego Międzynarodowa Unia Chemii Czystej i Stosowanej (IUPAC) stworzyła systematyczną nomenklaturę, w której związki nazywane są na podstawie liczby zawartych w nich atomów..
Jest to korzystne, jeśli chodzi o nazywanie tlenków azotu. Na przykład tlenek azotu mógłby być nazwany podtlenkiem azotu i podtlenkiem azotu (NO) podtlenkiem diazotu (NdwaLUB).
Dodatkowo w 1919 roku niemiecki chemik Alfred Stock opracował metodę nazywania związków chemicznych na podstawie stopnia utlenienia, zapisaną cyframi rzymskimi w nawiasach. Tak więc, na przykład, tlenek azotu i podtlenek azotu byłyby odpowiednio nazywane tlenkiem azotu (II) i tlenkiem azotu (I) (IUPAC, 2005).
Bibliografia
- (2005). NAZWA CHEMII NIEORGANICZNEJ Zalecenia IUPAC 2005. Odzyskany z iupac.org.
- Stany utlenienia azotu. (S.F.). Odzyskany z kpu.ca.
- Reusch, W. (5 maja 2013). Konfiguracje elektronowe w układzie okresowym. Odzyskany z chemistry.msu.edu.
- Reusch, W. (8 sierpnia 2015). Stany utleniania azotu. Odzyskany z chem.libretexts.org.
- Sanderson, R. T. (12 grudnia 2016). Pierwiastek z grupy azotu. Odzyskany z britannica.com.
- Tyagi, V. P. (2009). Podstawowa chemia XII. Nowe delikatesy: Ratna Sagar.
- Elektrony walencyjne. (S.F.). Odzyskany z chemistry.tutorvista.com.
- Wandell, A. (13 grudnia 2016). Chemia azotu. Odzyskany z chem.libretexts.org.


Jeszcze bez komentarzy