
Struktura tlenku baru (BaO), właściwości, zastosowania, zagrożenia

Plik tlenek baru Jest to nieorganiczna substancja stała utworzona przez atom baru (Ba) i atom tlenu (O). Jego wzór chemiczny to BaO. Jest to biała krystaliczna substancja stała i jest higroskopijna, to znaczy pochłania wilgoć z powietrza, ale reaguje z nią..
Szybka reakcja tlenku baru z wodą sprawia, że jest on stosowany w laboratoriach analiz chemicznych do wysychania, czyli usuwania wody z rozpuszczalników organicznych, które są związkami ciekłymi służącymi do rozpuszczania innych substancji..

BaO zachowuje się jak mocna zasada, dlatego reaguje z wieloma rodzajami kwasów. Na przykład łatwo reaguje z dwutlenkiem węgla COdwa z powietrza, tworząc węglan baru BaCO3.
Stosowany jest do produkcji polimerów do kabli energetycznych oraz jako składnik żywic do uszczelniania otworów w wyleczonych zębach.
Tlenek baru (BaO) jest również używany w przemyśle ceramicznym, zarówno do pokrywania go szkliwem, jak i do jego wytwarzania. Jest również stosowany w mieszankach cementowych w celu zwiększenia wytrzymałości na ściskanie produktu końcowego..
Indeks artykułów
- 1 Struktura
- 2 Nazewnictwo
- 3 Właściwości fizyczne
- 3.1 Stan fizyczny
- 3.2 Masa cząsteczkowa
- 3.3 Temperatura topnienia
- 3.4 Temperatura wrzenia
- 3.5 Gęstość
- 3.6 Rozpuszczalność
- 4 Właściwości chemiczne
- 5 Ryzyka
- 6 Otrzymywanie
- 7 zastosowań
- 7.1 Jako środek osuszający dla rozpuszczalników organicznych
- 7.2 W lampach wyładowczych
- 7.3 W produkcji ceramiki
- 7.4 W przygotowaniu mieszanek cementowych
- 7.5 W różnych zastosowaniach
- 8 Odniesienia
Struktura
BaO tlenku baru składa się z kationu Badwa+ i anion tlenu Odwa-.
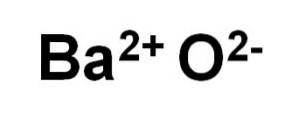
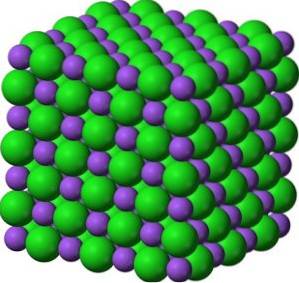
W swoich kryształach BaO tworzy sześcienne sieci jonowe (w kształcie sześcianu) typu chlorku sodu.
Konfiguracja elektronowa jonu baru to: [Xe] 6s0 ponieważ stracił dwa elektrony powłoki 6s. Ta konfiguracja jest bardzo stabilna.
Nomenklatura
-Tlenek baru
-Tlenek baru
Właściwości fizyczne
Stan fizyczny
Żółtawo-białe krystaliczne ciało stałe.
Waga molekularna
153,33 g / mol
Temperatura topnienia
1923 ° C
Temperatura wrzenia
Około 2000 ºC.
Gęstość
5,72 g / cm3
Rozpuszczalność
Słabo rozpuszczalny w wodzie: 3,8 g / 100 ml w 20 ºC.
Właściwości chemiczne
Tlenek baru BaO szybko reaguje z wodą, wydzielając ciepło i tworząc korozyjny roztwór wodorotlenku baru Ba (OH)dwa, który jest najlepiej rozpuszczalnym wodorotlenkiem spośród wodorotlenków metali ziem alkalicznych.
BaO + H.dwaO → Ba (OH)dwa
BaO to mocna podstawa. Reaguje egzotermicznie (tj. Wraz z wydzielaniem ciepła) ze wszystkimi typami kwasów.
Z COdwa BaO reaguje tworząc węglan baru BaCO3.
BaO + COdwa → BaCO3
BaO jest higroskopijny, więc pozostawiony wystawiony na działanie środowiska stopniowo łączy się z wilgocią powietrza, tworząc Ba (OH)dwa który łączy się z dwutlenkiem węgla COdwa z powietrza dając węglan baru BaCO3.
Gdy tlenek baru BaO jest podgrzewany w obecności powietrza, łączy się z tlenem tworząc nadtlenek baru BaOdwa. Reakcja jest odwracalna.
2 BaO + Odwa ⇔ 2 BaOdwa
W obecności wody może reagować z glinem Al lub cynkiem Zn, tworząc tlenki lub wodorotlenki tych metali i wytwarzając wodór H.dwa.
Może zainicjować polimeryzację polimeryzowalnych związków organicznych, takich jak epoksydy.
Ryzyka
Może działać toksycznie po połknięciu. Nie powinien wchodzić w kontakt ze skórą. Działa drażniąco na oczy, skórę i drogi oddechowe. Może być szkodliwy dla układu nerwowego. Może powodować niski poziom potasu, powodując zaburzenia pracy serca i mięśni.
Otrzymywanie
Tlenek baru BaO można otrzymać przez ogrzewanie węglanu baru BaCO3 z węglem drzewnym. Tworzy się BaO i uwalnia się gazowy tlenek węgla CO.
Bachus3 + C → BaO + 2 CO ↑
Aplikacje
Jako środek osuszający do rozpuszczalników organicznych
Ze względu na łatwość reagowania z wodą BaO jest stosowany od połowy ubiegłego wieku jako środek osuszający do benzyny i zasadowych lub obojętnych rozpuszczalników organicznych..
BaO jest bardzo aktywny susząc wokół siebie, bardzo szybko pochłania wilgoć, wydzielając sporo ciepła, tworząc wodorotlenek baru Ba (OH)dwa który jest stabilny do około 1000 ºC. Z tego powodu BaO można stosować w wysokich temperaturach..
Posiada również wysoką zdolność pochłaniania wody. Z każdej cząsteczki BaO można zaabsorbować jedną spośród wody i Ba (OH)dwa powstały może również wchłonąć pewną ilość wody.
Nadaje się do laboratoriów chemii analitycznej. Nie jest lepki.
Może być stosowany w eksykatorach, które są dużymi szklanymi pojemnikami z pokrywką, w których środowisko wewnętrzne jest suche. BaO utrzymuje suchą atmosferę miniaturowego eksykatora.

Te eksykatory służą do umieszczania substancji lub odczynników, zapobiegając w ten sposób wchłanianiu wody z otoczenia.
Służy również do suszenia gazów zasadowych, takich jak amoniak NH.3.
W lampach wyładowczych
BaO jest umieszczony na elektrodach lamp wyładowczych jako materiał emitujący elektrony.
Lampy wyładowcze są wykonane z rurki ze szkła, kwarcu lub innego odpowiedniego materiału, zawierają gaz obojętny iw większości przypadków opary metalu. Opary metaliczne mogą być sodem lub rtęcią.

Wyładowania elektryczne występują wewnątrz rury, ponieważ ma ona elektrodę dodatnią i ujemną.
BaO umieszcza się na elektrodach lampy. Elektrony, które emituje, zderzają się z atomami pary metalu i przekazują im energię..
Kiedy prąd elektryczny przepływa przez ten gaz lub parę, wytwarzane jest światło widzialne lub promieniowanie ultrafioletowe (UV)..
W produkcji ceramiki
BaO jest stosowany w ceramicznych kompozycjach powłokowych szkliwa.

Jednak został również przetestowany jako dodatek do przygotowania ceramiki szklanej.
BaO skutecznie poprawia właściwości mechaniczne i odporność chemiczną tego typu ceramiki. Ma silny wpływ na właściwości termiczne i skład fazy krystalicznej otrzymywanych materiałów..
W przygotowaniu mieszanek cementowych
BaO został przetestowany jako składnik cementu fosforoglinowego.
Ten rodzaj cementu jest przydatny w środowiskach morskich, ponieważ nie ma takiej samej tendencji do hydratacji jak inne rodzaje cementu, więc nie cierpi z powodu tworzenia się lub rozszerzania porów..
Jednak cementy fosforoglinianowe muszą zostać wzmocnione w swoich właściwościach mechanicznych, aby były odporne na prądy morskie i uderzenia unoszących się w oceanie kawałków lodu..
Dodatek BaO do cementu fosforoglinowego modyfikuje strukturę mineralną tego materiału, poprawia strukturę porów i znacznie zwiększa wytrzymałość zaczynu cementowego na ściskanie..
Innymi słowy, BaO poprawia wytrzymałość na ściskanie tego typu cementu..

W różnych zastosowaniach
Stosowany jest jako składnik nadający krycie w żywicach dentystycznych do wypełniania ubytków w zębach, wykonywany przez dentystów.
Jest również stosowany jako zarodek krystalizacji do wytwarzania polimerów fluorku poliwinylidenu stosowanych do izolacji kabli energetycznych..
Bibliografia
- Partyka, J. i in. (2016). Wpływ dodatku BaO na spiekanie materiałów szklano-ceramicznych z SiOdwa-DodwaLUB3-NadwaW PORZĄDKUdwaUkład O-CaO / MgO. J Therm Anal Calorim (2016) 125: 1095. Odzyskany z link.springer.com.
- Zhang, P. i in. (2019). Wpływ BaO na strukturę mineralną i właściwości hydratacyjne cementu fosforoglinowego. J Therm Anal Calorim (2019) 136: 2319. Odzyskany z link.springer.com.
- NAS. National Library of Medicine. (2019). Tlenek baru. Odzyskany z pubchem.ncbi.nlm.nih.gov.
- Smith, N.A. (2003). Oświetlenie. Zasada. W podręczniku inżyniera elektryka (wydanie szesnaste). Odzyskany z sciencedirect.com.
- Ebnesajjad, S. (2003). Pianki fluoropolimerowe. Pieniący się PVDF. Z przetwarzalnych w stanie stopionym fluoroplastów. Odzyskany z sciencedirect.com.
- Booth, H.S. i McIntyre, L.H. (1930). Tlenek baru jako środek pochłaniający wilgoć. Ind. Eng. Chem. Anal. Wyd. 1930, 2, 1, 12-15. Odzyskany z pubs.acs.org.


Jeszcze bez komentarzy