
Struktura, właściwości, zagrożenia i zastosowania tlenku etylenu
Plik Tlenek etylenu Jest to organiczny związek z rodziny epoksydów. W temperaturze pokojowej jest gazowy, bezbarwny i chociaż jest prawie bezwonny, ma łagodny, słodki zapach, podobny do zapachu eterów..
Jest to bardzo wszechstronny budulec chemiczny, ponieważ jest używany w wielu różnych zastosowaniach przemysłowych do produkcji innych związków chemicznych o wielu zastosowaniach. Wynika to z jego wysokiej reaktywności, czyli łatwości reagowania z innymi substancjami..
Jednym z jego głównych zastosowań jest surowiec do produkcji komponentów niezamarzających do chłodnic samochodowych. Jego pochodne są wykorzystywane jako składniki przemysłowych lub domowych środków czyszczących, kosmetyków i szamponów, plastyfikatorów, preparatów farmaceutycznych czy maści..
Jest to szeroko stosowany środek dezynfekujący, na przykład w sterylizacji sprzętu medycznego i dentystycznego, ponieważ jest zdolny do niszczenia wirusów, bakterii, grzybów i zarodników, szczególnie w suchych warunkach. Ponadto był używany do odkażania produktów spożywczych do pakowania, chociaż to zastosowanie jest kwestionowane.
Mimo swojej przydatności należy obchodzić się z nim z dużą ostrożnością, ponieważ może powodować podrażnienia oczu i skóry. Wdychanie tlenku etylenu przez długi czas może wpływać na układ nerwowy. Dlatego osoby narażone na jego opary lub roztwory powinny używać sprzętu ochronnego i odzieży ochronnej..
Indeks artykułów
- 1 Struktura
- 2 Właściwości
- 2.1 Inne nazwy
- 2.2 Stan fizyczny
- 2.3 Masa cząsteczkowa
- 2.4 Temperatura zapłonu
- 2.5 Gęstość
- 2.6 Rozpuszczalność
- 2.7 Temperatura samozapłonu
- 2.8 Inne właściwości
- 3 Produkcja
- 4 Ryzyka
- 4.1 Dla zdrowia
- 4.2 Ogień
- 5 zastosowań
- 5.1 Zastosowania przemysłowe
- 5.2 Zastosowania medyczne
- 5.3 Biblioteki i muzea
- 5.4 Rolnictwo i żywność
- 6 Odnośniki
Struktura
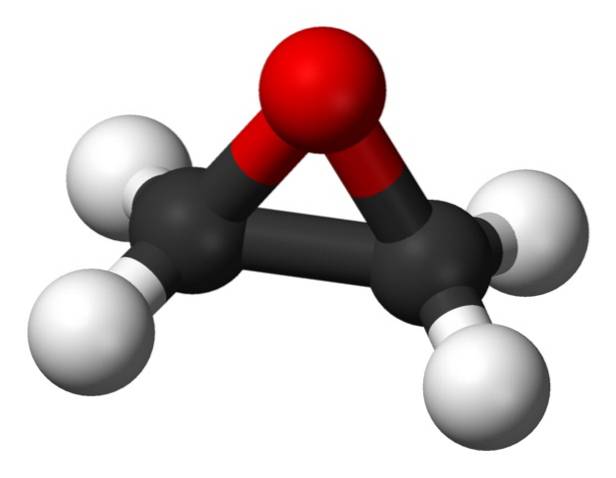
Jego wzór cząsteczkowy to C.dwaH.4O. Należy do grupy epoksydów, będąc z nich najprostszymi i najważniejszymi. Ma kształt trójczłonowego pierścienia.
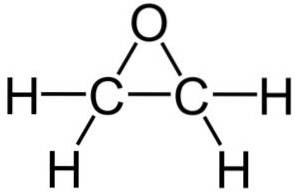
Ze względu na trójkątną strukturę pierścienia tlenek etylenu jest bardzo reaktywny, co wynika z łatwości, z jaką pierścień się otwiera. Średnio kąty wiązania wynoszą 60 °, co powoduje, że twoje wiązania są słabe. Cząsteczka jest mniej stabilna niż liniowy eter i łatwo reaguje z innymi związkami chemicznymi..
Nieruchomości
Inne nazwy
- Oxirano.
- Epoksyetan.
Stan fizyczny
W temperaturze pokojowej i pod ciśnieniem atmosferycznym jest gazem. Poniżej 10,6 ºC i pod ciśnieniem atmosferycznym jest cieczą. Poniżej -111 ºC jest to ciało stałe.
Waga molekularna
44,05 g / mol.
Temperatura zapłonu
Mniej niż 0ºF (-17,8ºC).
Gęstość
Jego gęstość jest niższa niż wody i wynosi 0,882 przy 10ºC. Z kolei jego opary są cięższe od powietrza.
Rozpuszczalność
Jest rozpuszczalny w wodzie, benzenie, acetonie, etanolu i eterze. Jest mieszalny z czterochlorkiem węgla.
Temperatura samozapłonu
428,9 ° C.
Inne właściwości
- Poddany ogrzewaniu lub zanieczyszczeniu może polimeryzować egzotermicznie (wytwarzając duże ilości ciepła). Jeśli polimeryzacja zachodzi w pojemniku, może gwałtownie pęknąć.
- Może reagować z materiałami utleniającymi.
- Jest niezwykle toksyczny, rakotwórczy i jest dobrym generatorem mutacji w komórkach bakterii i ssaków..
Produkcja
Na skalę przemysłową jest przygotowywany przez utlenianie etylenu tlenem (Odwa) z powietrza. Szybkość tej reakcji wzrasta wraz z obecnością metalicznego srebra (Ag) i działaniem temperatury. Reakcja jest pokazana poniżej:
Ag, 250ºC
2 CdwaH.4 + LUBdwa -> 2CdwaH.4LUB
Etylen Tlenek etylenu
Ryzyka
Za zdrowie
- Zgłaszano, że powoduje zaburzenia neurologiczne i może powodować śmierć. Najniższe stężenie, które może wywołać toksyczne skutki przy wdychaniu, wynosi 12500 ppm / 10 sekund (ppm oznacza: części na milion).
- Działa silnie drażniąco na skórę, oczy i drogi oddechowe..
- Narażenie na opary tlenku etylenu o wysokim stężeniu może powodować podrażnienie oczu, zapalenie błony oka i uszkodzenie rogówki..
- Rozwój zaćmy wiąże się z narażeniem na jej opary i rozpryski. Skoncentrowane roztwory powodują poważne uszkodzenie oczu.
- Kontakt wodnych roztworów tlenku etylenu ze skórą powoduje podrażnienia i może prowadzić do ciężkiego zapalenia skóry z pęcherzami i oparzeniami..
- Wdychanie może wpływać na układ nerwowy, powodując między innymi bóle głowy i nudności..
Ogień
- Wystawienie na działanie płomienia lub ciepła grozi wybuchem. Podczas podgrzewania powstają niebezpieczne opary.
- Opary tworzą z powietrzem mieszaniny wybuchowe w szerokim zakresie stężeń.
- Unikaj obsługi sprzętu zawierającego metale, takie jak miedź, srebro, rtęć, magnez, aluminium lub tlenki żelaza, a także środków zapobiegających, takich jak między innymi amoniak, utleniacze, kwasy organiczne lub zasady. Wszystkie te materiały mogą przyspieszyć ich polimeryzację i / lub wybuch.
Aplikacje
Zastosowania przemysłowe
Służy jako pośrednik przy produkcji innych chemikaliów, które z kolei są wykorzystywane do produkcji włókien poliestrowych na odzież, obicia, dywany i poduszki..
Tlenek etylenu wytwarza glikol etylenowy stosowany w niezamarzającym silniku pojazdu. Glikol etylenowy jest również używany do produkcji folii opakowaniowych z włókna szklanego i tworzyw sztucznych..
Inne chemikalia wytwarzane z tlenku etylenu obejmują niejonowe środki powierzchniowo czynne stosowane w detergentach i preparatach do zmywania naczyń..
Zastosowania medyczne
Stosowany jest jako środek sterylizujący do sprzętu medycznego, takiego jak narzędzia chirurgiczne, igły i iniektory podskórne lub protezy.
Służy również do sterylizacji m.in. maszyn do hemodializy, sprzętu laboratoryjnego, narzędzi stomatologicznych, instrumentów weterynaryjnych, termometrów, odzieży chirurgicznej czy sprzętu pierwszej pomocy..

Chociaż istnieje kilka metod sterylizacji sprzętu medycznego, w niektórych zastosowaniach żadne dostępne leczenie nie może zastąpić tlenku etylenu..
Tak jest w przypadku sterylizacji niektórych materiałów wrażliwych na ciepło i promieniowanie, a także niektórych instrumentów i urządzeń, które wymagają sterylizacji w miejscu użycia w szpitalach..
Biblioteki i muzea
W tych miejscach tlenek etylenu jest używany do zwalczania szkodników, takich jak grzyby i owady. Jednak to zastosowanie nie jest tak powszechne i jest używane, gdy inne alternatywy nie są skuteczne..
Rolnictwo i żywność
Był stosowany między innymi jako pestycyd, fungicyd, fumigant, herbicyd, insektycyd, rodentycyd. Znacząco ogranicza liczebność bakterii i grzybów w przyprawach.
Jednak ze względów bezpieczeństwa i ochrony środowiska stosowanie tlenku etylenu do fumigacji żywności zostało zakazane w Unii Europejskiej i Stanach Zjednoczonych..
Bibliografia
- NAS. National Library of Medicine. (2019). Tlenek etylenu. Odzyskany z pubchem.ncbi.nlm.nih.gov
- Fakty dotyczące bezpieczeństwa chemicznego. (2019). Tlenek etylenu. Odzyskany z chemicalafetyfacts.org
- Morrison, Robert Thornton; i Boyd, Robert Neilson. 1992. Chemia organiczna. Prentice-Hall.
- Moerman, F. i Mager, K. (2016). Czyszczenie i dezynfekcja w zakładach przetwórstwa suchej żywności. W Handbook of Hygiene Control in the Food Industry (wydanie drugie). Odzyskany z sciendirect.com.
- Eastmond, David A. i Balakrishnan, Sharada. (2010). Genotoksyczność pestycydów. W Handbook of Pesticide Toxicology Hayesa (wydanie trzecie). Odzyskany z sciencedirect.com
- Atungulu, G.G. i Pan, Z. (2012). Odkażanie mikrobiologiczne orzechów i przypraw. W odkażaniu mikrobiologicznym w przemyśle spożywczym. Odzyskany z sciencedirect.com

Jeszcze bez komentarzy