
Formuła tlenku ołowiu (PbO), właściwości, zagrożenia i zastosowania

Plik rdza pionowa, Tlenek ołowiu (II) lub tlenek ołowiu to związek chemiczny o wzorze PbO. Występuje w dwóch odmianach polimorficznych: litharge i masicotite. Jego strukturę ilustruje rysunek 1.
Wracając do składu, litr to utleniony produkt stopionego ołowiu, który został zmieszany lub rozpylony w celu wprowadzenia powietrza, a następnie schłodzony i zmielony w celu utworzenia żółtego proszku..
Nazwa masicotite jest używana zarówno dla rodzimego minerału, jak i dla produktu zawierającego tlenek ołowiu wytwarzanego przez podgrzanie węglanu ołowiu do 300ºC (Tlenek ołowiu, 2016). Te minerały przedstawiono na rysunku 2.

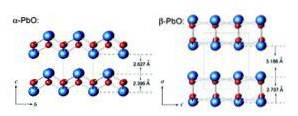
Masicotite ma strukturę rombową, podczas gdy litr ma tetragonalną strukturę krystaliczną. Tlenek ołowiu (II) ma zdolność zmiany struktury po podgrzaniu lub schłodzeniu. Struktury te pokazano na rysunku 3.
PbO jest wytwarzany przez utlenianie metalicznego ołowiu. Metal jest topiony do produkcji tabletek ołowianych, a następnie mielony w temperaturze 170 ~ 210 ° C i przepuszczany przez płomień w celu utlenienia w temperaturach powyżej 600 ℃. Produkty tlenkowe są kruszone w celu uzyskania gotowego tlenku ołowiu (Kirk-Othmer, 1995).
2Pb + O2 → 2PbO
PbO jest produkowany na dużą skalę jako półprodukt w rafinacji rud ołowiu w metaliczny ołów. Zastosowanym minerałem ołowiu jest galena (siarczek ołowiu (II)). W wysokiej temperaturze (1000 ° C) siarczek przekształca się w tlenek w następujący sposób:
2PbS + 3O2 → 2PbO + 2SO2
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne rdzy pionowej
- 2 Reaktywność i zagrożenia
- 3 Zastosowania
- 4 Odnośniki
Właściwości fizyczne i chemiczne tlenku ołowiu
Tlenek ołowiu może mieć dwa różne wyglądy: jako żółty suchy proszek o strukturze rombowej (masicotyt) lub jako czerwonawe tetragonalne kryształy (litr). Oba sposoby przedstawiono na rysunku 4.

Związek ma masę cząsteczkową 223,20 g / mol i gęstość 9,53 g / ml. Ma temperaturę topnienia 888 ° C i temperaturę wrzenia 1470 ° C (National Center for Biotechnology Information, S.F.).
Związek jest bardzo słabo rozpuszczalny w wodzie, będąc w stanie rozpuścić zaledwie 0,0504 gramów na litr w 25 ° C w postaci masicotytu i 0,1065 gramów na litr w 25 ° C w postaci litu. Związek jest również nierozpuszczalny w alkoholu. Jest rozpuszczalny w kwasie octowym, rozcieńczonym HNO3 i alkaliach (Royal Society of Chemistry, 2015).
Związek jest słabym środkiem utleniającym lub redukującym, jednak nadal mogą zachodzić reakcje redoks. Te związki nie reagują z wodą.
Tlenek ołowiu po podgrzaniu utlenia węglik glinu żarząc. Mieszaniny tlenku ołowiu z pyłem aluminiowym (podobnie jak inne metale: sód, cyrkon) powodują gwałtowną eksplozję.
Reaktywność i zagrożenia
Tlenek ołowiu to związek klasyfikowany jako trujący. Substancja jest toksyczna dla ośrodkowego układu nerwowego i może być rakotwórcza dla ludzi (Karta Charakterystyki Tlenek ołowiu, żółty, 2013).
Wczesnym objawem zatrucia są zmarszczki ołowiu, które pojawiają się na brzegach dziąseł, a skóra szarzeje. Zespół neurasteniczny powstanie również w początkowym okresie zatrucia..
Zatrucie móżdżku może spowodować depresję zatrucia ołowiem, manię zatrucia ołowiem, a także toksyczność ołowiu i wrażliwość na paraliż wielokrotnego zapalenia nerwów.
Zatrucie ołowiem może również powodować niedokrwistość hipochromiczną oraz zaburzenia endokrynologiczne i metaboliczne. Ponadto zatrucie ołowiem może hamować aktywność niektórych enzymów w układzie pokarmowym i powodować niestrawność, silny ból brzucha i uszkodzenie wątroby. Może również powodować wysokie ciśnienie krwi i podwyższony poziom cholesterolu..
Jeśli występuje silny ból brzucha, można podjąć pewne środki, takie jak podskórne wstrzyknięcie atropiny i innych leków, gorący brzuch, lewatywa, gorąca kąpiel i tak dalej. Maksymalne dopuszczalne stężenie w powietrzu wynosi 0,01 mg / m3 (tlenek ołowiu, 2016).
W przypadku kontaktu z oczami lub skórą należy przemyć dużą ilością wody. W przypadku wdychania lub połknięcia ofiarę należy zabrać do wentylowanego miejsca. Nie należy wywoływać wymiotów. Jeśli ofiara nie oddycha, należy przeprowadzić resuscytację usta-usta.
We wszystkich przypadkach należy natychmiast zwrócić się o pomoc lekarską. Tlenek ołowiu jest związkiem szkodliwym dla środowiska, bioakumulacja tej substancji chemicznej może zachodzić w roślinach i ssakach.
Stanowczo zaleca się, aby substancja nie dostała się do środowiska, dlatego należy się z nią obchodzić i przechowywać zgodnie z ustalonymi przepisami (Narodowy Instytut Bezpieczeństwa i Higieny Pracy, 2015).
Aplikacje
Tlenek ołowiu był używany jako środek do suszenia farb i jako środek o niskim przepływie ognia w produkcji ceramiki i szkła. Szkło kryształowe ołowiowe służy do produkcji wysokiej jakości zastawy stołowej.
Wykorzystując tlenek ołowiu jako topnik, można otrzymać szkło o wysokim współczynniku załamania światła, a co za tym idzie o pożądanej jasności (British Encyclopedia, 2016).
Półmetaliczne przewodniki ceramiczne mają najwyższą przewodność ze wszystkich materiałów ceramicznych z wyjątkiem nadprzewodzących. Przykładem tego typu ceramiki półmetalicznej jest tlenek ołowiu. Materiały te mają zachodzące na siebie pasma energii elektronów i dlatego są doskonałymi przewodnikami elektronicznymi (Mason, 2008).
Tlenek ołowiu jest stosowany głównie w lampach elektronowych, kineskopach, szkle optycznym, szkle ołowiowym przeciw promieniom rentgenowskim i gumach odpornych na promieniowanie..
Służy jako odczynnik analityczny do przepływu krzemianów, ale także do wytrącania aminokwasów
Tlenek ołowiu jest używany do produkcji stabilizatorów tworzyw sztucznych PVC, a także jest surowcem do innych soli ołowiu. Jest również używany do rafinacji ropy naftowej oraz do oznaczania złota i srebra..
Jest również używany jako żółty pigment w farbach i emaliach. Masicotite był używany jako pigment przez artystów od XV do XVIII wieku.
Cienkie warstwy tlenku ołowiu są używane do produkcji opalizujących kolorów mosiądzu i brązu. Litharge miesza się z gliceryną, aby zrobić cement hydrauliczny.
Bibliografia
- Encyklopedia Britannica. (10 października 2016). Szkło. Odzyskany z britannica: britannica.com.
- Kirk-Othmer. (1995). Encyklopedia technologii chemicznej. 4th ed. Tomy 1. Nowy Jork: John Wiley and Sons.
- Tlenek ołowiu. (1 maja 2016). Odzyskany z cameo.mfa: cameo.mfa.org.
- Tlenek ołowiu. (2016). Odzyskane z Chemicalbook: chemicalbook.com.
- Mason, T. O. (2008, 12 marca). Ceramika przewodząca. Odzyskany z britannica: britannica.com.
- Karta charakterystyki materiału Tlenek ołowiu żółty. (2013, 21 maja). Odzyskany z sciencelab: sciencelab.com.
- Narodowe Centrum Informacji Biotechnologicznej. (S.F.). Baza danych PubChem Compound; CID = 14827. Odzyskany z PubChem: pubchem.ncbi.nlm.nih.gov.
- Narodowy Instytut Bezpieczeństwa i Higieny Pracy. (22 lipca 2015). TLENEK OŁOWIU (II). Odzyskany z cdc.gov: cdc.gov.
- Królewskie Towarzystwo Chemii. (2015). Tlenek ołowiu (II). Odzyskany z chemspider: chemspider.com.



Jeszcze bez komentarzy