
Historia, właściwości, struktura, pozyskiwanie, zagrożenia, zastosowania jodu
Plik jod Jest to reaktywny pierwiastek niemetaliczny należący do grupy 17 układu okresowego (halogeny) i reprezentowany przez symbol chemiczny I. W istocie jest to dość popularny pierwiastek, od wody jodowanej po hormon tyrozynę..
W stanie stałym jod jest ciemnoszary z metalicznym połyskiem (dolny obraz), zdolny do sublimacji z wytworzeniem fioletowej pary, która po skondensowaniu na zimnej powierzchni pozostawia ciemną pozostałość. Liczne i atrakcyjne były eksperymenty mające na celu zademonstrowanie tych cech.

Pierwiastek ten po raz pierwszy wyodrębnił Bernard Curtois w 1811 roku, uzyskując związki, które posłużyły jako surowiec do produkcji saletry. Jednak Curtois nie zidentyfikował jodu jako pierwiastka, zasługa podzielana przez Josepha Gay-Lussaca i Humphry'ego Davy'ego. Gay-Lussac zidentyfikował ten element jako „iode”, termin pochodzący od greckiego słowa „ioides”, którym oznaczono kolor fioletowy..
Jod elementarny, podobnie jak inne halogeny, jest cząsteczką dwuatomową, składającą się z dwóch atomów jodu połączonych wiązaniem kowalencyjnym. Interakcja Van der Waalsa między cząsteczkami jodu jest najsilniejsza wśród halogenów. To wyjaśnia, dlaczego jod jest halogenem o najwyższych temperaturach topnienia i wrzenia. Ponadto jest najmniej reaktywny z halogenów i ma najniższą elektroujemność..
Jod jest niezbędnym pierwiastkiem, który należy spożywać, ponieważ jest niezbędny do wzrostu organizmu; rozwój mózgu i umysłu; metabolizm, itp., zalecając dzienne spożycie 110 µg / dzień.
Niedobór jodu w stanie płodowym człowieka wiąże się z pojawieniem się kretynizmu, stanem charakteryzującym się spowolnieniem wzrostu ciała; a także niedostateczny rozwój umysłowy i intelektualny, zez itp..
Tymczasem niedobór jodu w każdym wieku osobnika wiąże się z pojawieniem się wola, charakteryzującego się przerostem tarczycy. Wole jest chorobą endemiczną, ponieważ ogranicza się do pewnych obszarów geograficznych o własnych właściwościach odżywczych.
Indeks artykułów
- 1 Historia
- 1.1 Odkrycie
- 1.2 Pojawienie się nazwy
- 1.3 Zastosowania historyczne
- 2 Właściwości fizyczne i chemiczne
- 2.1 Wygląd
- 2.2 Standardowa masa atomowa
- 2.3 Liczba atomowa (Z)
- 2.4 Temperatura topnienia
- 2.5 Temperatura wrzenia
- 2.6 Gęstość
- 2.7 Rozpuszczalność
- 2.8 Zapach
- 2.9 Współczynnik podziału oktanol / woda
- 2.10 Rozkład
- 2.11 Lepkość
- 2.12 Punkt potrójny
- 2.13 Punkt krytyczny
- 2.14 Ciepło topnienia
- 2.15 Ciepło parowania
- 2.16 Molowa pojemność cieplna
- 2.17 Prężność par
- 2.18 stopni utlenienia
- 2.19 Elektroujemność
- 2.20 Energia jonizacji
- 2.21 Przewodność cieplna
- 2.22 Oporność elektryczna
- 2.23 Porządek magnetyczny
- 2.24 Reaktywność
- 3 Struktura i konfiguracja elektroniczna
- 3.1 - Atom jodu i jego wiązania
- 3.2 - Kryształy
- 3.3 - Fazy
- 4 Gdzie znaleźć i otrzymać
- 4.1 Caliche
- 4.2 Solanka
- 5 Rola biologiczna
- 5.1 - Zalecana dieta
- 5.2 - Hormony tarczycy
- 5.3 - Niedobór
- 6 Ryzyka
- 7 zastosowań
- 7.1 Lekarze
- 7.2 Reakcje i działanie katalityczne
- 7.3 Fotografia i optyka
- 7.4 Inne zastosowania
- 8 Odniesienia
Fabuła
Odkrycie
Jod został odkryty przez francuskiego chemika Bernarda Curtoisa w 1811 r., Kiedy pracował z ojcem przy produkcji saletry, wymagając do tego węglanu sodu..
Związek ten został wyizolowany z wodorostów zebranych u wybrzeży Normandii i Bretanii. W tym celu spalono algi, a popiół przemyto wodą, niszcząc powstałe pozostałości dodatkiem kwasu siarkowego..
Pewnego razu, być może przez przypadkowy błąd, Curtois dodał nadmiar kwasu siarkowego i utworzyła się fioletowa para, która krystalizowała na zimnych powierzchniach, osiadając w postaci ciemnych kryształów. Curtois podejrzewał, że był w obecności nowego pierwiastka i nazwał go „substancją X”.
Curtois odkrył, że ta substancja po zmieszaniu z amoniakiem tworzy brązową substancję stałą (trójjodek azotu), która eksploduje przy najmniejszym kontakcie.
Jednak Curtois miał ograniczenia, aby kontynuować swoje badania i postanowił przekazać próbki swojej substancji Charlesowi Desormesowi, Nicolasowi Clémentowi, Josephowi Gay-Lussacowi i André-Marie Ampère w celu nawiązania współpracy..
Pojawienie się nazwy
W listopadzie 1813 roku Desormes i Clément upublicznili odkrycie Curtoisa. W grudniu tego samego roku Gay-Lussac zwrócił uwagę, że nowa substancja może być nowym elementem, sugerując nazwę „jod” od greckiego słowa „ioides”, oznaczającego fiolet..
Sir Humphry Davy, który otrzymał część próbki podaną Ampère przez Curtois, eksperymentował z próbką i zauważył podobieństwo do chloru. W grudniu 1813 roku Królewskie Towarzystwo w Londynie było zaangażowane w identyfikację nowego elementu.
Chociaż między Gay-Lussakiem i Davy'm wybuchła dyskusja na temat identyfikacji jodu, obaj przyznali, że Curtois był pierwszym, który go wyodrębnił. W 1839 Curtois ostatecznie otrzymał nagrodę Montyna od Królewskiej Akademii Nauk w uznaniu za izolację jodu..
Zastosowania historyczne
W 1839 roku Louis Daguerre po raz pierwszy zastosował jod w celach komercyjnych, wymyślając metodę wytwarzania obrazów fotograficznych zwanych dagerotypami na cienkich arkuszach metalu..
W 1905 roku amerykański patolog David Marine zbadał niedobór jodu w niektórych chorobach i zalecił jego spożycie.
Fizyczne i chemiczne właściwości
Wygląd

Jednolity ciemnoszary z metalicznym połyskiem. Po sublimacji jego opary są koloru fioletowego (górne zdjęcie).
Standardowa masa atomowa
126.904 u
Liczba atomowa (Z)
53
Temperatura topnienia
113,7 ° C
Temperatura wrzenia
184,3 ° C
Gęstość
Temperatura otoczenia: 4,933 g / cm3
Rozpuszczalność
Rozpuszcza się w wodzie tworząc brązowe roztwory o stężeniu 0,03% w temperaturze 20 ºC..
Ta rozpuszczalność jest znacznie zwiększona, jeśli istnieją wcześniej rozpuszczone jony jodkowe, ponieważ równowaga jest ustalona między I- i jadwa tworząc gatunek anionowy I.3-, który solwatuje lepiej niż jod.
W rozpuszczalnikach organicznych, takich jak chloroform, czterochlorek węgla i dwusiarczek węgla, jod rozpuszcza się, dając purpurowy odcień. Podobnie rozpuszcza się w związkach azotowych, takich jak pirydyna, chinolina i amoniak, ponownie tworząc brązowy roztwór.
Różnica w zabarwieniu polega na tym, że jod rozpuszcza się w postaci solwatowanych cząsteczek I.dwa, lub jako kompleksy przeładunkowe; te ostatnie pojawiają się, gdy są rozpuszczalnikami polarnymi (wśród nich woda), które zachowują się jak zasady Lewisa, przekazując elektrony jodowi.
Zapach
Ostry, drażniący i charakterystyczny. Próg zapachu: 90 mg / m3 i drażniący próg zapachu: 20 mg / m3.
Współczynnik podziału oktanol / woda
Log P = 2,49
Rozkład
Po podgrzaniu do rozkładu wydziela dym jodowodoru i różnych związków jodkowych..
Lepkość
2,27 cP w 116 ° C
Potrójny punkt
386,65 K i 121 kPa
Punkt krytyczny
819 K i 11,7 MPa
Ciepło topnienia
15,52 kJ / mol
Ciepło parowania
41,57 kJ / mol
Molowa pojemność cieplna
54,44 J / (mol K)
Ciśnienie pary
Jod ma umiarkowaną prężność pary i po otwarciu pojemnika powoli sublimuje do fioletowej pary, podrażniając oczy, nos i gardło..
Liczby utleniania
Stopnie utlenienia jodu to: -1 (I-), +1 (I+), +3 (I3+), +4 (I4+), +5 (I5+), +6 (I.6+) i +7 (I.7+). We wszystkich solach jodkowych, podobnie jak w przypadku KI, jod ma stopień utlenienia -1, ponieważ w nich mamy anion I-.
Jod uzyskuje dodatnie stopnie utlenienia, gdy jest połączony z pierwiastkami bardziej elektroujemnymi niż on; na przykład w jego tlenkach (IdwaLUB5 i ja4LUB9) lub związki międzyfluorowcowane (I-F, I-Cl i I-Br).
Elektroujemność
2,66 w skali Paulinga
Energia jonizacji
Pierwsza: 1008,4 kJ / mol
Po drugie: 1845 kJ / mol
Po trzecie: 3180 KJ / mol
Przewodność cieplna
0,449 W / (m · K)
Rezystancja
1,39 107 Ω · m przy 0 ºC
Porządek magnetyczny
Diamagnetyczny
Reaktywność
Jod łączy się z większością metali, tworząc jodki, a także z pierwiastkami niemetalicznymi, takimi jak fosfor i inne halogeny. Jon jodkowy jest silnym środkiem redukującym, który samorzutnie uwalnia elektron. Utlenianie jodku daje brązowawy odcień jodu.
Jod w przeciwieństwie do jodku jest słabym utleniaczem; słabszy od bromu, chloru i fluoru.
Jod o stopniu utlenienia +1 może łączyć się z innymi halogenami o stopniu utlenienia -1, dając halogenki jodu; na przykład: bromek jodu, IBr. Podobnie łączy się z wodorem, tworząc jodowodór, który po rozpuszczeniu w wodzie nazywany jest kwasem jodowodorowym..
Kwas jodowodorowy jest bardzo mocnym kwasem zdolnym do tworzenia jodków w wyniku reakcji z metalami lub ich tlenkami, wodorotlenkami i węglanami. Jod ma stopień utlenienia +5 w kwasie jodowym (HIO3), który jest odwodniony do produkcji pentatlenku jodu (IdwaLUB5).
Struktura i konfiguracja elektroniczna
- Atom jodu i jego wiązania

Jod w stanie podstawowym składa się z atomu, który ma siedem elektronów walencyjnych, z których tylko jeden jest w stanie uzupełnić swój oktet i stać się izoelektronicznym z ksenonem będącym gazem szlachetnym. Te siedem elektronów jest ułożonych na swoich orbitaliach 5s i 5p zgodnie z ich konfiguracją elektroniczną:
[Kr] 4d10 5sdwa 5 pkt5
Dlatego atomy I wykazują silną tendencję do wiązania kowalencyjnego, tak że każdy z nich ma osiem elektronów w swojej najbardziej zewnętrznej powłoce. W ten sposób dwa atomy I zbliżają się i tworzą wiązanie I-I, które definiuje dwuatomową cząsteczkę I.dwa (górne zdjęcie); molekularna jednostka jodu w jego trzech stanach skupienia w normalnych warunkach.
Obraz przedstawia cząsteczkę Idwa reprezentowany przez przestrzenny model wypełnienia. Jest to nie tylko cząsteczka dwuatomowa, ale także homojądrowa i niepolarna; więc ich intermolekularne interakcje (I.dwa - jadwa) są rządzone przez siły dyspersji Londynu, które są wprost proporcjonalne do ich masy cząsteczkowej i wielkości atomów.
To wiązanie I-I jest jednak słabsze w porównaniu z innymi halogenami (F-F, Cl-Cl i Br-Br). Jest to teoretycznie spowodowane słabym zachodzeniem na siebie ich orbitali hybrydowych sp3.
- Kryształy
Masa cząsteczkowa I.dwa pozwala jej siłom rozpraszającym być odpowiednio ukierunkowanym i wystarczająco silnym, aby utworzyć kryształ rombowy pod ciśnieniem otoczenia. Wysoka zawartość elektronów powoduje, że światło promuje niekończące się przejścia energii, co powoduje, że kryształy jodu zabarwiają się na czarno.
Jednak gdy jod sublimuje, jego opary przybierają fioletowe zabarwienie. To już wskazuje na bardziej specyficzne przejście w obrębie orbitali molekularnych Idwa (te o najwyższej energii lub anty-link).
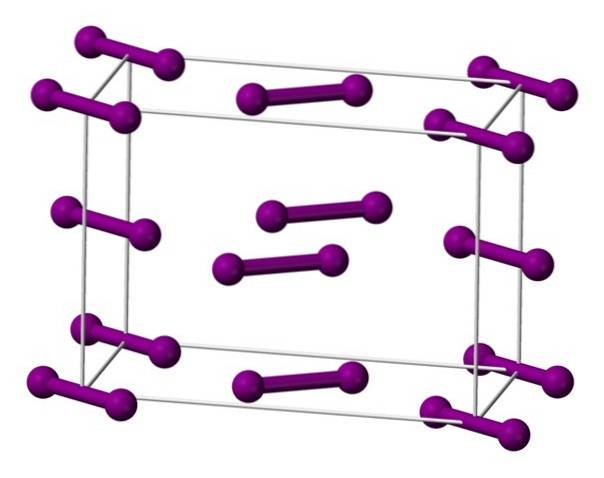
Cząsteczki I pokazano powyżejdwa, reprezentowany przez model sfer i prętów, rozmieszczonych w rombowej komórce elementarnej.
Można zauważyć, że są dwie warstwy: dolna z pięcioma cząsteczkami i środkowa z czterema. Zwróć również uwagę, że u podstawy komórki znajduje się cząsteczka jodu. Szkło jest budowane poprzez okresowe rozprowadzanie tych warstw we wszystkich trzech wymiarach..
Poruszając się w kierunku równoległym do wiązań I-I, okazuje się, że orbitale jodu zachodzą na siebie, tworząc pasmo przewodzenia, które czyni ten element półprzewodnikiem; jednak jego zdolność do przewodzenia energii elektrycznej zanika, jeśli przestrzega się kierunku prostopadłego do warstw.
Odległości łącza
Wydaje się, że łącze I-I się rozszerzyło; i faktycznie tak jest, ponieważ długość jego wiązania wzrasta od 266 pm (stan gazowy) do 272 pm (stan stały).
Może to wynikać z faktu, że w gazie cząsteczki Idwa są bardzo daleko od siebie, a ich siły międzycząsteczkowe są prawie nieistotne; podczas gdy w ciele stałym siły te (I-I - I-I) stają się namacalne, przyciągając do siebie atomy jodu dwóch sąsiednich cząsteczek iw konsekwencji skracając odległość międzycząsteczkową (lub inaczej widzianą międzyatomową).
Następnie, gdy kryształ jodu sublimuje, wiązanie I-I kurczy się w fazie gazowej, ponieważ sąsiednie cząsteczki nie wywierają już tej samej (dyspersyjnej) siły przyciągania na swoje otoczenie. A także, logicznie, odległość I.dwa - jadwa wzrasta.
- Fazy
Wspomniano wcześniej, że wiązanie I-I jest słabsze w porównaniu z innymi halogenami. W fazie gazowej w temperaturze 575 ºC 1% cząsteczek Idwa rozpadają się na pojedyncze atomy I. Energii cieplnej jest tak dużo, że tylko dwa ja znów się spotykają, rozdzielają się i tak dalej.
Podobnie, to zerwanie wiązania może wystąpić, jeśli na kryształy jodu zostanie przyłożony ogromny nacisk. Poprzez zbyt silne ściśnięcie (pod ciśnieniem setki tysięcy razy wyższym niż atmosferyczne), cząsteczki Idwa są przearanżowane w jednoatomową fazę I, i mówi się, że jod wykazuje właściwości metaliczne.
Istnieją jednak inne fazy krystaliczne, takie jak: rombowa centrowana na ciele (faza II), tetragonalna centrowana na ciele (faza III) i sześcienna centrowana na powierzchni (faza IV).
Gdzie znaleźć i uzyskać
Jod ma stosunek wagowy do skorupy ziemskiej 0,46 ppm, zajmując 61. miejsce pod względem obfitości. Minerały jodkowe są rzadkie, a złoża jodu nadające się do komercyjnej eksploatacji to jodany..
Minerały jodu występują w skałach magmowych o stężeniu od 0,02 mg / kg do 1,2 mg / kg oraz w skałach magmowych o stężeniu od 0,02 mg do 1,9 mg / kg. Można go również znaleźć w łupkach Kimmeridge o stężeniu 17 mg / kg masy.
Ponadto minerały jodu znajdują się w skałach fosforanowych o stężeniu od 0,8 do 130 mg / kg. Woda morska ma stężenie jodu wahające się od 0,1 do 18 µg / l. Dawniej głównym źródłem jodu były wodorosty, gąbki i ostrygi.
Obecnie jednak głównymi źródłami są caliche, złoża azotanu sodu na pustyni Atacama (Chile) oraz solanki, głównie z japońskiego pola gazowego w Minami Kanto na wschód od Tokio oraz ze złoża gazowego Anadarko. Basen w Oklahomie (USA).
Caliche
Jod jest ekstrahowany z kaliszu w postaci jodanu i poddawany działaniu wodorosiarczynu sodu w celu zredukowania go do jodku. Następnie roztwór poddaje się reakcji ze świeżo wyekstrahowanym jodanem, aby ułatwić jego filtrację. Caliche było głównym źródłem jodu w XIX i na początku XX wieku..
Solanka
Po oczyszczeniu solankę poddaje się działaniu kwasu siarkowego, który wytwarza jodek..
Ten roztwór jodku jest następnie poddawany reakcji z chlorem w celu wytworzenia rozcieńczonego roztworu jodu, który jest odparowywany przez strumień powietrza kierowany do wieży absorpcyjnej dwutlenku siarki, powodując następującą reakcję:
jadwa + 2 godzdwaO + SOdwa => 2 HI + Hdwapołudniowy zachód4
Następnie gazowy jodowodór reaguje z chlorem, uwalniając jod w stanie gazowym:
2 HI + Cldwa => Idwa + 2 HCl
Na koniec jod jest filtrowany, oczyszczany i pakowany do użycia..
Rola biologiczna
- Zalecana dieta
Jod jest pierwiastkiem niezbędnym, ponieważ wpływa na liczne funkcje istot żywych, które są szczególnie znane u ludzi. Jod może dostać się do człowieka jedynie poprzez pokarm, który zjada.
Zalecana dieta na jod zmienia się wraz z wiekiem. Zatem 6-miesięczne dziecko wymaga spożycia 110 µg / dzień; ale od 14 roku życia zalecana dieta to 150 µg / dzień. Ponadto stwierdza się, że spożycie jodu nie powinno przekraczać 1100 µg / dzień.
- Hormony tarczycy
Hormon stymulujący tarczycę (TSH) jest wydzielany przez przysadkę mózgową i stymuluje wychwyt jodu przez pęcherzyki tarczycy. Jod przenoszony jest do pęcherzyków tarczycy, zwanych koloidami, gdzie wiąże się z aminokwasem tyrozyną, tworząc monojodotyrozynę i dijodotyrozynę..
W koloidzie pęcherzykowym cząsteczka monojodotyroniny łączy się z cząsteczką dijodotyroniny, tworząc cząsteczkę zwaną trijodotyroniną (T3). Z drugiej strony dwie cząsteczki dijodotyrozyny mogą łączyć się, tworząc tetrajodotyroninę (T4). T3 i T4 nazywane są hormonami tarczycy.
Hormony T.3 oraz T4 są wydzielane do osocza, gdzie wiążą się z białkami osocza; w tym białko transportujące hormony tarczycy (TBG). Większość hormonów tarczycy jest transportowana w osoczu jako T.4.
Jednak aktywną postacią hormonów tarczycy jest T.3, więc T4 w „białych narządach” hormonów tarczycy ulega odjodowaniu i przekształca się w T3 wywrzeć swoje działanie hormonalne.
Efekty Edytuj
Skutki działania hormonów tarczycy są wielorakie, można wskazać: zwiększony metabolizm i syntezę białek; promocja wzrostu ciała i rozwoju mózgu; podwyższone ciśnienie krwi i tętno itp..
- Niedobór
Niedobór jodu, a tym samym hormonów tarczycy, zwany niedoczynnością tarczycy, ma liczne konsekwencje, na które wpływa wiek osoby..
Jeśli niedobór jodu występuje w stanie płodowym danej osoby, najbardziej istotną konsekwencją jest kretynizm. Ten stan charakteryzuje się takimi objawami, jak upośledzenie funkcji umysłowych, opóźniony rozwój fizyczny, zez i opóźnione dojrzewanie płciowe..
Niedobór jodu może wywołać wolę, niezależnie od wieku, w którym występuje niedobór. Wole to nadmierny rozwój tarczycy, spowodowany nadmierną stymulacją gruczołu przez hormon TSH, uwalniany z przysadki mózgowej w wyniku niedoboru jodu..
Nadmierny rozmiar tarczycy (wole) może uciskać tchawicę, ograniczając przepływ przez nią powietrza. Ponadto może powodować uszkodzenie nerwów krtaniowych, co może prowadzić do chrypki..
Ryzyka
Zatrucie nadmiernym spożyciem jodu może spowodować oparzenia ust, gardła i gorączkę. Również bóle brzucha, nudności, wymioty, biegunka, słaby puls i śpiączka.
Nadmiar jodu wywołuje niektóre objawy obserwowane przy niedoborze: następuje zahamowanie syntezy hormonów tarczycy, co zwiększa wydzielanie TSH, co skutkuje przerostem tarczycy; czyli wola.
Istnieją badania, które wskazują, że nadmierne spożycie jodu może powodować zapalenie tarczycy i raka brodawkowatego tarczycy. Ponadto nadmierne spożycie jodu może wchodzić w interakcje z lekami, ograniczając ich działanie..
Nadmierne spożycie jodu w połączeniu z lekami przeciwtarczycowymi, takimi jak metimazol, stosowanymi w leczeniu nadczynności tarczycy, może mieć działanie addytywne i powodować niedoczynność tarczycy..
Inhibitory enzymu konwertującego angiotensynę (ACE), takie jak benazepril, są stosowane w leczeniu nadciśnienia. Przyjmowanie zbyt dużej ilości jodku potasu zwiększa ryzyko hiperkaliemii i nadciśnienia.
Aplikacje
Lekarze
Jod działa jako środek odkażający skórę lub rany. Ma niemal natychmiastowe działanie przeciwdrobnoustrojowe, wnikając do wnętrza mikroorganizmów i oddziałując z aminokwasami siarkowymi, nukleotydami i kwasami tłuszczowymi, co powoduje śmierć komórki.
Działa antywirusowo głównie na zakryte wirusy, postulując, że atakuje białka na powierzchni pokrytych wirusów..
Jodek potasu w postaci stężonego roztworu stosowany jest w leczeniu tyreotoksykozy. Służy również do kontrolowania skutków promieniowania 131I poprzez blokowanie wiązania radioaktywnego izotopu z tarczycą.
Jod jest stosowany w leczeniu dendrytycznego zapalenia rogówki. Aby to zrobić, rogówka jest wystawiona na działanie oparów wody nasyconych jodem, tymczasowo tracąc nabłonek rogówki; ale całkowite wyzdrowienie następuje po dwóch lub trzech dniach.
Jod ma również korzystne działanie w leczeniu mukowiscydozy piersi człowieka. Wskazano również, że 131Mógłbym być opcjonalnym leczeniem raka tarczycy.
Reakcje i działanie katalityczne
Jod służy do wykrywania obecności skrobi, nadając jej niebieski odcień. Reakcja jodu ze skrobią służy również do wykrywania fałszywych banknotów wydrukowanych na papierze zawierającym skrobię..
Czterojodortęcian potasu (II), znany również jako odczynnik Nesslera, jest używany do wykrywania amoniaku. Podobnie zasadowy roztwór jodu jest używany w teście jodoformowym, aby wykazać obecność ketonów metylowych..
Nieorganiczne jodki są używane do oczyszczania metali, takich jak tytan, cyrkon, hafn i tor. Na jednym etapie procesu muszą powstać tetrajodki tych metali.
Jod służy jako stabilizator kalafonii, oleju i innych produktów drzewnych.
Jod jest stosowany jako katalizator w reakcjach syntezy organicznej metylacji, izomeryzacji i odwodornienia. Tymczasem kwas jodowodorowy jest używany jako katalizator do produkcji kwasu octowego w procesach Monsanto i Cativa..
Jod działa jako katalizator w kondensacji i alkilowaniu amin aromatycznych, a także w procesach siarczanowania i sulfanowania oraz do produkcji kauczuków syntetycznych.
Fotografia i optyka
Jodek srebra jest podstawowym składnikiem tradycyjnego filmu fotograficznego. Jod jest używany do produkcji instrumentów elektronicznych, takich jak pryzmaty monokrystaliczne, polaryzacyjne instrumenty optyczne i szkło zdolne do przepuszczania promieni podczerwonych..
Inne zastosowania
Jod jest używany do produkcji pestycydów, barwników anilinowych i ftaleiny. Ponadto znajduje zastosowanie w syntezie barwników oraz jest środkiem gaśniczym. I wreszcie jodek srebra służy jako jądro kondensacji pary wodnej w chmurach, powodując deszcz..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Stuart Ira Fox. (2003). Ludzka psychologia. Pierwsza edycja. Edytować. McGraw-Hill Interamericana
- Wikipedia. (2019). Jod. Odzyskane z: en.wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi i Onoda Mitsuko. (2003). Modulowana struktura jodu w stanie stałym podczas jego dysocjacji molekularnej pod wysokim ciśnieniem. Tom Nature 423, strony 971-974. doi.org/10.1038/nature01724
- Chen L. i in. (1994). Strukturalne przemiany fazowe jodu pod wysokim ciśnieniem. Instytut Fizyki, Academia Sinica, Pekin. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider i Karl Christe. (26 sierpnia 2019). Jod. Encyclopædia Britannica. Odzyskany z: britannica.com
- Dr Doug Stewart. (2019). Fakty dotyczące pierwiastka jodu. Chemicool. Źródło: chemicool.com
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Jod. Baza danych PubChem. CID = 807. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Rohner, F., Zimmermann, M., Jooste, P., Pandav, C., Caldwell, K., Raghavan, R., & Raiten, D. J. (2014). Biomarkery odżywiania dla rozwoju - przegląd jodu. The Journal of odżywiania, 144 (8), 1322S-1342S. doi: 10.3945 / jn.113.181974
- Advameg. (2019). Jod. Wyjaśnienie chemii. Odzyskany z: chemistryexplained.com
- Traci Pedersen. (19 kwietnia 2017). Fakty o jodzie. Odzyskane z: livescience.com
- Megan Ware, RDN, LD. (30 maja 2017). Wszystko, co musisz wiedzieć o jodzie. Odzyskany z: medicalnewstoday.com
- Narodowy Instytut Zdrowia. (9 lipca 2019). Jod. Odzyskany z: ods.od.nih.gov



Jeszcze bez komentarzy