
Charakterystyka, rodzaje, funkcje cyklazy adenylanowej
Plik cyklaza adenylanowa lub cyklaza adenylowa jest enzymem odpowiedzialnym za konwersję ATP, wysokoenergetycznej cząsteczki, do cyklicznego AMP, ważnej cząsteczki sygnałowej, która aktywuje różne zależne od cyklicznie białka AMP o ważnych funkcjach fizjologicznych.
Jego aktywność jest kontrolowana przez różne czynniki, takie jak na przykład skoordynowane działanie hormonów, neuroprzekaźników i innych cząsteczek regulatorowych o różnym charakterze (między innymi dwuwartościowe jony wapnia i białka G)..
Główne znaczenie tego enzymu polega na znaczeniu produktu reakcji, którą katalizuje, cyklicznego AMP, gdyż uczestniczy on w kontroli wielu zjawisk komórkowych związanych z metabolizmem i rozwojem, a także w odpowiedzi na różne bodźce zewnętrzne..
W naturze zarówno organizmy jednokomórkowe (stosunkowo proste), jak i duże i złożone zwierzęta wielokomórkowe używają cyklicznego AMP jako drugiego przekaźnika, a zatem enzymów, które go wytwarzają..
Badania filogenetyczne wykazały, że enzymy te pochodzą od wspólnego przodka przed rozdzieleniem eubakterii i eukariontów, co sugeruje, że cykliczny AMP miał różne funkcje, być może związane z produkcją ATP..
Można przyjąć takie stwierdzenie, ponieważ reakcja katalizowana przez cyklazę adenylanową jest łatwo odwracalna, co można zauważyć przy stałej równowagi dla syntezy ATP (K.eq ≈ 2,1 ± 0,2 10-9 Mdwa).
Indeks artykułów
- 1 Charakterystyka i struktura
- 1.1 Charakterystyka strukturalna
- 1.2 Miejsce katalityczne
- 1.3 Lokalizacja
- 2 rodzaje
- 2.1 Ssacze cyklazy adenylanowe
- 3 Funkcje
- 4 rozporządzenia
- 5 Referencje
Charakterystyka i struktura
Większość eukariotycznych enzymów cyklazy adenylanowej jest związanych z błoną plazmatyczną, ale w bakteriach i plemnikach ssaków występują one jako rozpuszczalne białka w cytozolu.
U drożdży i niektórych bakterii są białkami błony obwodowej, podczas gdy u niektórych gatunków ameb są cząsteczkami z pojedynczym segmentem transbłonowym.
Charakterystyka strukturalna
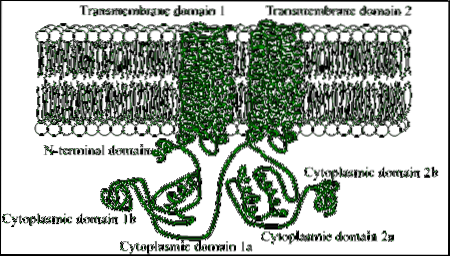
Są to białka złożone z dużych łańcuchów polipeptydowych (ponad 1000 reszt aminokwasowych), które przecinają błonę plazmatyczną 12 razy przez dwa regiony złożone z sześciu domen transbłonowych o konformacji alfa helisy..
Każdy region transbłonowy jest oddzielony dużą domeną cytozolową, która jest odpowiedzialna za aktywność katalityczną..
Wśród organizmów eukariotycznych są pewne konserwatywne motywy we fragmencie regionu aminoterminalnego tych enzymów, a także domena cytoplazmatyczna o masie około 40 kDa, ograniczona odcinkami hydrofobowymi..
Strona katalityczna
Reakcja, którą katalizują te enzymy, to znaczy tworzenie wiązania diestrowego poprzez nukleofilowy atak grupy OH w pozycji 3 'na grupę fosforanową trifosforanu nukleozydu w pozycji 5', zależy od wspólnego motywu strukturalnego znanego jako domena Palm ”.
Ta domena „dłoni” składa się z motywu „βαβααβ„(„ Β ”oznacza arkusze złożone w β i„ α ”helisy alfa) i ma dwie niezmienne reszty kwasu asparaginowego, które koordynują dwa jony metali odpowiedzialne za katalizę, którymi mogą być dwuwartościowe jony magnezu lub magnezu. Cynk.
Wiele badań związanych z czwartorzędową strukturą tych enzymów ujawniło, że ich jednostka katalityczna istnieje jako dimer, którego tworzenie zależy od segmentów transbłonowych, które łączą się w siateczce endoplazmatycznej podczas tworzenia białka..
Lokalizacja
Stwierdzono, że podobnie jak wiele integralnych białek błonowych, takich jak białka G, te z kotwicami fosfatydyloinozytolu i wiele innych, cyklazy adenylowe znajdują się w specjalnych regionach błonowych lub mikro-domenach znanych jako „tratwy lipidowe” (z angielskiego „Tratwa lipidowa”).
Te domeny błonowe mogą mieć średnicę do setek nanometrów i składają się głównie z cholesterolu i sfingolipidów z długimi i przeważnie nasyconymi łańcuchami kwasów tłuszczowych, co czyni je mniej płynnymi i umożliwia umieszczanie transbłonowych segmentów różnych białek.
Cyklazy adenylanowe zostały również znalezione w podregionach tratw lipidowych znanych jako „caveolae” (z angielskiego „caveolae ”), które są raczej wgłębieniami błony bogatej w cholesterol i związane z nim białko zwane kaweoliną.
Rodzaje
W naturze istnieją trzy dobrze zdefiniowane klasy cyklazy adenylanowej i dwie, które są obecnie przedmiotem dyskusji..
- Klasa I: są obecne w wielu bakteriach Gram-ujemnych, takich jak E coli, na przykład, gdy cykliczny produkt reakcji AMP pełni funkcję liganda dla czynników transkrypcyjnych odpowiedzialnych za regulację operonów katabolicznych.
- Klasa II: występuje w niektórych patogenach z rodzajów bakterii, takich jak Bakcyl lub Bordetella, gdzie służą jako toksyny zewnątrzkomórkowe. Są to białka aktywowane przez kalmodulinę żywiciela (nieobecne w bakteriach).
- Klasa III: są znane jako klasa „uniwersalna” i są filogenetycznie spokrewnione z cyklazami guanylanowymi, które pełnią podobne funkcje. Występują zarówno u prokariontów, jak i eukariontów, gdzie są regulowane różnymi ścieżkami.
Ssacze cyklazy adenylanowe
U ssaków co najmniej dziewięć typów tych enzymów zostało sklonowanych i opisanych, kodowanych przez dziewięć niezależnych genów i należących do cyklazy adenylowej klasy III..
Mają one złożone struktury i topologie błon, a także zduplikowane domeny katalityczne, które są dla nich charakterystyczne..
W przypadku ssaków nomenklatura stosowana w odniesieniu do izoform odpowiada literom AC (od cyklaza adenylanowa) i liczbę od 1 do 9 (AC1 - AC9). Doniesiono również o dwóch wariantach enzymu AC8.
Izoformy obecne u tych zwierząt są homologiczne pod względem sekwencji pierwotnej struktury ich miejsc katalitycznych i struktury trójwymiarowej. Włączenie jednego z tych enzymów do każdego „typu” jest głównie związane z mechanizmami regulacyjnymi, które działają na każdą izoformę.
Mają wzorce ekspresji, które często są specyficzne dla tkanki. Wszystkie izoformy można znaleźć w mózgu, chociaż niektóre są ograniczone do określonych obszarów ośrodkowego układu nerwowego.
funkcje
Główną funkcją enzymów należących do rodziny cyklaz adenylanowych jest przekształcanie ATP w cykliczne AMP iw tym celu katalizują one tworzenie wewnątrzcząsteczkowego wiązania diestrowego 3'-5 '(reakcja podobna do tej katalizowanej przez polimerazy DNA). cząsteczki pirofosforanu.
U ssaków różne warianty, które można osiągnąć, były związane z proliferacją komórek, uzależnieniem od etanolu, plastycznością synaps, uzależnieniem od leków, rytmem okołodobowym, stymulacją węchową, uczeniem się i pamięcią..
Niektórzy autorzy zasugerowali, że cyklazy adenylanowe mogą pełnić dodatkową funkcję jako cząsteczki transporterów lub, co jest tym samym, białka kanałowe i transportery jonowe..
Jednak te hipotezy zostały przetestowane tylko w oparciu o układ lub topologię segmentów transbłonowych tych enzymów, które mają pewne homologie lub podobieństwa strukturalne (ale nie sekwencję) z pewnymi kanałami transportującymi jony..
Zarówno cykliczny AMP, jak i PPi (pirofosforan), które są produktami reakcji, pełnią funkcje na poziomie komórkowym; ale ich znaczenie zależy od organizmu, w którym się znajdują.
Rozporządzenie
Ogromne zróżnicowanie strukturalne cyklaz adenylowych wskazuje na dużą podatność na wiele form regulacji, co pozwala im na integrację z wieloma różnymi szlakami sygnalizacji komórkowej..
Aktywność katalityczna niektórych z tych enzymów zależy od alfa ketokwasów, podczas gdy inne mają znacznie bardziej złożone mechanizmy regulacyjne, które obejmują podjednostki regulatorowe (poprzez stymulację lub hamowanie), które zależą na przykład od wapnia i innych ogólnie rozpuszczalnych czynników, a także innych białka.
Wiele cyklaz adenylanowych jest regulowanych negatywnie przez podjednostki niektórych białek G (hamują ich funkcję), podczas gdy inne wywierają bardziej aktywujący wpływ.
Bibliografia
- Cooper, D. M. F. (2003). Regulacja i organizacja cyklaz adenylowych i cAMP. Biochemical Journal, 375, 517-529.
- Cooper, D., Mons, N. i Karpen, J. (1995). Cyklazy adenylylowe i interakcja między sygnalizacją wapnia i cAMP. Natura, 374, 421-424.
- Danchin, A. (1993). Filogeneza cyklaz adenylowych. Postępy w badaniach nad drugim posłańcem i fosfoproteiną, 27, 109-135.
- Hanoune, J. i Defer, N. (2001). Regulacja i rola izoform cyklazy adenylowej. Ann. Rev. Pharmacol. Toxicol., 41, 145-174.
- Linder, U., & Schultz, J. E. (2003). Cyklazy adenylowe klasy III: wielofunkcyjne moduły sygnalizacyjne. Sygnalizacja komórkowa, piętnaście, 1081-1089.
- Tang, W., & Gilman, A. G. (1992). Cyklazy adenylylowe. Komórka, 70, 669-672.


Jeszcze bez komentarzy