
Podłoże, przygotowanie i stosowanie agaru EMB
Plik Agar EMB jest selektywną i zróżnicowaną stałą pożywką hodowlaną stosowaną do izolacji pałeczek Gram-ujemnych, głównie z rodziny Enterobacteriaceae, oraz innych niewymagających wyborów pałeczek Gram-ujemnych. Jest również znany pod akronimem EAM, który oznacza eozynę-błękit metylenowy..
Podłoże to zostało stworzone przez Holt-Harris i Teague w 1916 roku. Zawiera pepton, laktozę, sacharozę, fosforan dipotasowy, agar, eozynę, błękit metylenowy i wodę. Jest bardzo podobny do MacConkey Agar, szczególnie w przypadku stosowania Levine's Modified EMB Agar, który nie zawiera sacharozy.
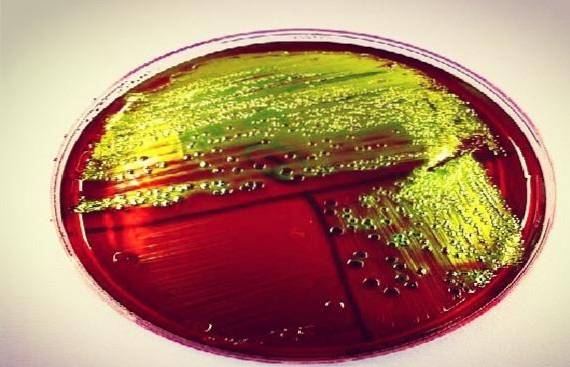
W rzeczywistości każde laboratorium decyduje, czy pracować z jednym, czy z drugim, ponieważ spełniają tę samą funkcję, chociaż biochemicznie są różne..
Ma nawet tę samą wadę, co klasyczny agar MacConkey, jeśli chodzi o produkcję rojową przez rodzaj Proteus. Dlatego, aby uniknąć tego zjawiska, stężenie agaru można zwiększyć nawet o 5%..
Indeks artykułów
- 1 Uzasadnienie
- 1.1 Selektywne
- 1.2 Różnicowe
- 2 Przygotowanie
- 3 Zastosowania
- 4 Kontrola jakości
- 5 Uwagi końcowe
- 6 Odnośniki
Podstawa
Selektywny
Agar EMB jest subtelnie selektywny, ponieważ zawiera barwniki anilinowe (eozynę i błękit metylenowy), które działają jak inhibitory, zapobiegając rozwojowi większości bakterii Gram-dodatnich i niektórych wybrednych pałeczek Gram-ujemnych..
Jednak ten agar ma tę wadę, że niektóre bakterie Gram-dodatnie są odporne na obecność substancji hamujących i rosną jako małe, bezbarwne, punktowe kolonie, takie jak Enterococcus faecalis a niektóre Staphylococcus.
Mogą również rosnąć niektóre drożdże, takie jak Kompleks Candida albicans, co da bardzo małe różowe kolonie. Chlamydospory mogą nawet rozwinąć się z tych drożdży, jeśli próbka jest głęboko zaszczepiona..
Mechanizm różnicowy
Z drugiej strony agar EMB jest również pożywką różnicową, ponieważ te barwniki razem (eozyna i błękit metylenowy) mają właściwość tworzenia osadu przy kwaśnym pH, dlatego służą jako wskaźniki jego wytwarzania..
Tak więc bakterie słabo fermentujące laktozę lub sacharozę wytwarzają fioletowe kolonie w ciągu 24 do 48 godzin. Na przykład rodzaje Klebsiella, Enterobacter i Serratia.
Bakterie, które silnie fermentują laktozę, np Escherichia coli, lub sacharoza Yersinia enterocolitica lub Proteus penneri, tworzą zielonkawo-czarny osad, nadający charakterystyczny metaliczny połysk u tych gatunków.
Należy zauważyć, że w przypadku stosowania pożywki z lewiną EMB (bez sacharozy), Yersinia enterocolitica Y Proteus penneri dadzą wyraźne kolonie.
Bakterie, które nie fermentują laktozy lub sacharozy, odżywiają się obecnością peptonów, które dostarczają aminokwasów i azotu niezbędnych do wzrostu bakterii i tworzą klarowne kolonie. Na przykład między innymi rodzaje Salmonella i Shigella.
Podobnie należy zauważyć, że rodzaj Acinetobacter może tworzyć kolonie o barwie lawendowo-błękitnej, mimo że nie jest to fermentator laktozy ani sacharoza, ale ma właściwość wiązania błękitu metylenowego na ścianie komórkowej. Może się to również zdarzyć w przypadku innych bakterii oksydacyjnych.
Przygotowanie
Oryginalne odwodnione podłoże jest koloru jasnobeżowego.
Aby przygotować tę pożywkę hodowlaną, 36 gramów odwodnionej pożywki należy zważyć i zawiesić w kolbie zawierającej 1 litr wody destylowanej..
Po odstawieniu mieszaniny na 5 minut, przenieść kolbę do źródła ciepła, energicznie i stale mieszając, aż się zagotuje i całkowicie się rozpuści..
Następnie już rozpuszczoną pożywkę hodowlaną należy wyjaławiać w autoklawie w temperaturze 121 ° C przez 15 minut..
Pod koniec czasu jest wyjmowany z autoklawu i pozostawiany na chwilę w spoczynku. Następnie, jeszcze ciepły (45–50 ° C), podaje się 15–20 ml agaru na każdą sterylną szalkę Petriego. Medium powinno być lakmusowo niebieskie.
Po serwowaniu płytki pozostawia się lekko odkryte, aż agar nieco ostygnie. Następnie przykrywa się je i pozostawia do całkowitego zestalenia. Następnie zamawia się je w odwróconych uchwytach na płytki i przechowuje w lodówce (8 ° C) do czasu użycia..
Ta procedura jest korzystnie przeprowadzana w okapie z przepływem laminarnym lub przed palnikiem Bunsena, aby uniknąć zanieczyszczenia.
Należy pamiętać, że każdy dom handlowy wskaże ilość do zważenia w celu przygotowania pożywki hodowlanej..
Końcowe pH pożywki musi wynosić 7,2 ± 0,2
Aplikacje
Podłoże to służy do wysiewu moczu i kału lub dowolnego rodzaju materiału klinicznego, zwłaszcza jeśli podejrzewa się obecność niewymagających bakterii Gram-ujemnych, takich jak pałeczki z rodziny Enterobacteriaceae, które bardzo dobrze rosną na tym podłożu..
Bakterie enteropatogenne z rodzajów Shigella i Salmonella wyróżniają się bezbarwnymi lub lekko bursztynowymi koloniami.
Rosną również inne pałeczki niefermentujące laktozy, takie jak między innymi Aeromonas, Pseudomonas, Acinetobacter..
Pożywka ta jest również bardzo przydatna w analizie mikrobiologicznej żywności i wody, ponieważ jest idealna do pełnej fazy potwierdzającej oznaczanie bakterii z grupy coli, to znaczy do potwierdzenia obecności bakterii z grupy coli. E coli z mętnych bulionów EC, z techniki najbardziej prawdopodobnej liczby (MPN).
QA
Aby sprawdzić, czy świeżo przygotowana pożywka działa dobrze, można posadzić szczepy kontrolne, aby obserwować cechy kolonii i sprawdzić, czy dają zgodnie z oczekiwaniami..
W tym celu szczepy ATCC lub dobrze zidentyfikowane szczepy E coli, Enterobacter aerogenes, Klebsiella sp, Salmonella typhimurium, Shigella flexneri, Pseudomonas aeruginosa i niektóre bakterie Gram-dodatnie, takie jak S. aureus.
Oczekuje się, że E coli Tworzą dobrze rozwinięte niebieskawo-czarne kolonie z zielonym metalicznym połyskiem. Podczas, Enterobacter aerogenes Y Klebsiella sp powinny dawać dobrze rozwinięte niebieskawo-czarne kolonie śluzowe.
Ze swojej strony, Salmonella typhimurium Y Shigella flexneri, powinny tworzyć duże, bezbarwne lub lekko bursztynowe kolonie.
Wreszcie gatunek Pseudomonas aeruginosa rośnie jako bezbarwne kolonie o nieregularnych rozmiarach, podczas gdy bakterie Gram-dodatnie powinny być całkowicie zahamowane lub rosnąć rzadko przy bardzo małych koloniach.
Końcowe przemyślenia
Czasami sterylizacja powoduje redukcję błękitu metylenowego, uzyskując średnio pomarańczowy kolor. Aby błękit metylenowy utleniał się i odzyskał purpurowy kolor, należy go delikatnie mieszać, aż do odzyskania koloru..
Ponadto po sterylizacji barwnik może wytrącić się, dlatego należy go dobrze wymieszać przed podaniem na szalkach Petriego..
Bibliografia
- Camacho A, Giles M, Ortegón A, Palao M, Serrano B i Velázquez O. 2009. Techniques for the Microbiological Analysis of Foods. 2nd ed. Wydział Chemii UNAM. Meksyk.
- Carranza C, León R, Falcón N, Neumann A, Kromm C. Escherichia coli Potencjalnie chorobotwórczy wyizolowany z kurczaków brojlerów z ferm drobiu w Peru. Rev. Investiga. weterynarz. Peru 2012 23 (2): 209–219. Dostępne pod adresem: scielo.org.
- Laboratorios Conda SA Agar z eozyną i błękitem metylenowym. 2010 Dostępne pod adresem: condalab.com
- Britannia Laboratories. Levine E.M.B (z eozyną i błękitem metylenowym) 2011 Dostępne pod adresem: britanialab.com
- BD Laboratories. BD EMB Agar (Eosin Methylene Blue Agar), zmodyfikowany. 2013 Dostępne na: bd.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnoza mikrobiologiczna. (Wyd. 5). Argentyna, od redakcji Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott Microbiological Diagnosis. 12 ed. Argentyna. Od redakcji Panamericana S.A
Jeszcze bez komentarzy