
Struktura, właściwości, nazewnictwo, zastosowania alkoholi wtórnych
ZA alkohol wtórny Zawiera węgiel nośnikowy grupy hydroksylowej (OH), przyłączony do dwóch atomów węgla. Podczas gdy w alkoholu pierwszorzędowym węgiel niosący grupę hydroksylową jest przyłączony do jednego atomu węgla, aw alkoholu trzeciorzędowym jest przyłączony do trzech atomów węgla..
Alkohole są nieco słabszymi kwasami niż woda i mają następujące pKa: woda (15,7); alkohole metylowe (15,2), etylowe (16), izopropylowe (alkohol drugorzędowy, 17) i tert-butylowe (18). Jak widać, alkohol izopropylowy jest mniej kwaśny niż alkohole metylowy i etylowy..
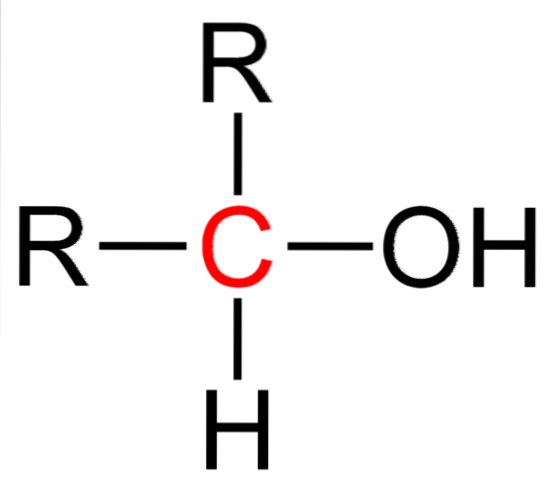
Górny obraz przedstawia wzór strukturalny drugorzędowego alkoholu. Węgiel zaznaczony na czerwono jest nośnikiem OH i jest połączony z dwiema grupami alkilowymi (lub arylowymi) R i pojedynczym atomem wodoru.
Wszystkie alkohole mają ogólny wzór ROH; ale jeśli szczegółowo obserwuje się węgiel nośnikowy, to alkohole pierwszorzędowe (RCHdwaOH), wtórne (RdwaCHOH, tutaj podniesiony) i trzeciorzędny (R.3COH). Fakt ten ma wpływ na jego właściwości fizyczne i reaktywność..
Indeks artykułów
- 1 Struktura drugorzędowego alkoholu
- 2 Właściwości
- 2.1 Punkty wrzenia
- 2.2 Kwasowość
- 2.3 Reakcje
- 3 Nazewnictwo
- 4 Zastosowania
- 5 przykładów
- 5.1 2-oktanol
- 5.2 Estradiol lub 17β-Estradiol
- 5.3 20-hydroksy-leukotrien
- 5,4 2-heptanol
- 6 Odnośniki
Struktura alkoholu wtórnego
Struktury alkoholi zależą od charakteru grup R. Jednakże w przypadku alkoholi drugorzędowych można dokonać pewnych przykładów, biorąc pod uwagę, że mogą istnieć tylko struktury liniowe z rozgałęzieniami lub bez lub struktury cykliczne. Na przykład masz następujący obraz:
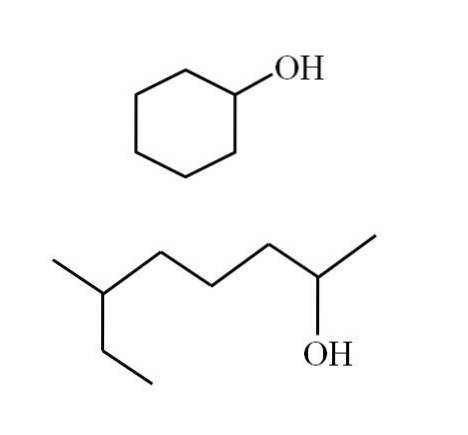
Zauważ, że dla obu struktur jest coś wspólnego: OH jest połączony z „V”. Każdy koniec V reprezentuje równą grupę R (górna część obrazu, struktura cykliczna) lub inną (dolna część, rozgałęziony łańcuch).
W ten sposób każdy alkohol wtórny jest bardzo łatwy do zidentyfikowania, nawet jeśli jego nazewnictwo jest w ogóle nieznane..
Nieruchomości
Punkty wrzenia
Właściwości alkoholi drugorzędowych nie różnią się fizycznie zbytnio od innych alkoholi. Zwykle są to przezroczyste ciecze i aby być ciałem stałym w temperaturze pokojowej, muszą utworzyć kilka wiązań wodorowych i mieć dużą masę cząsteczkową.
Jednak ten sam wzór strukturalny RdwaCHOH wskazuje na pewne właściwości, charakterystyczne dla tych alkoholi. Na przykład grupa OH jest mniej eksponowana i dostępna dla oddziaływań wiązań wodorowych, R.dwaCH-OH-OHCHRdwa.
Dzieje się tak, ponieważ grupy R, sąsiadujące z węglem zawierającym OH, mogą przeszkadzać i utrudniać tworzenie wiązań wodorowych. W rezultacie alkohole drugorzędowe mają niższą temperaturę wrzenia niż alkohole pierwszorzędowe (RCHdwaO).
Kwasowość
Zgodnie z definicją Brönsteda-Lowry'ego kwasem jest ten, który przekazuje protony lub jony wodoru, H.+. Kiedy dzieje się tak z drugorzędnym alkoholem, masz:
RdwaCHOH + B- => R.dwaCHO- + HB
Baza koniugatu RdwaCHO-, anion alkoholanowy musi stabilizować swój ładunek ujemny. W przypadku alkoholu drugorzędowego stabilizacja jest niższa, ponieważ dwie grupy R mają gęstość elektronową, która odpycha w pewnym stopniu ujemny ładunek na atomie tlenu..
Tymczasem dla anionu alkoholanowego alkoholu pierwszorzędowego RCHdwaLUB-, jest mniej odpychania elektronicznego, ponieważ jest tylko jedna grupa R, a nie dwie. Ponadto atomy wodoru nie wywierają znaczącego odpychania, a wręcz przeciwnie, przyczyniają się do stabilizacji ładunku ujemnego..
Dlatego alkohole drugorzędowe są mniej kwaśne niż alkohole pierwszorzędowe. Jeśli tak jest, to są one bardziej podstawowe iz dokładnie tych samych powodów:
RdwaCHOH + Hdwab+ => R.dwaCHOHdwa+ + HB
Teraz grupy R stabilizują dodatni ładunek tlenu, rezygnując z części jego gęstości elektronowej..
Reakcje
Halogenowodór i trihalogenek fosforu
Alkohol drugorzędowy może reagować z halogenowodorem. Przedstawiono równanie chemiczne reakcji między alkoholem izopropylowym i kwasem bromowodorowym w środowisku kwasu siarkowego i wytwarzaniem bromku izopropylu:
CH3CHOHCH3 + HBr => CH3CHBrCH3 + H.dwaLUB
Może również reagować z trójhalogenem fosforu, PX3 (X = Br, I):
CH3-CHOH-CHdwa-CHdwa-CH3 + PBr3 => CH3-CHBr-CHdwa-CHdwa-CH3 + H.3PO3
Powyższe równanie chemiczne odpowiada reakcji między sec-pentanolem i tribromkiem fosforu, powstającym z bromku sec-pentylu.
Należy zauważyć, że w obu reakcjach drugorzędowy halogenek alkilu (RdwaCHX).
Odwodnienie
W tej reakcji H i OH z sąsiednich atomów węgla są tracone, tworząc podwójne wiązanie między tymi dwoma atomami węgla. Dlatego powstaje alken. Reakcja wymaga katalizatora kwasowego i dostarczania ciepła.
Alkohol => Alkene + H.dwaLUB
Na przykład mamy następującą reakcję:
Cykloheksanol => cykloheksen + HdwaLUB
Reakcja z metalami aktywnymi
Alkohole wtórne mogą reagować z metalami:
CH3-CHOH-CH3 + K => CH3CHO-K.+CH3 + ½ H.+
Tutaj alkohol izopropylowy reaguje z potasem, tworząc sól izoproksydową jonów potasowych i wodorowych..
Estryfikacja
Alkohol drugorzędowy reaguje z kwasem karboksylowym, tworząc ester. Na przykład równanie chemiczne reakcji alkoholu sec-butylowego z kwasem octowym w celu wytworzenia octanu sec-butylu jest pokazane:
CH3CHOHCHdwaCH3 + CH3COOH <=> CH3COOCHCH3CHdwaCH3
Utlenianie
Pierwszorzędowe alkohole są utleniane do aldehydów, które z kolei są utleniane do kwasów karboksylowych. Ale drugorzędowe alkohole są utleniane do acetonu. Reakcje są zwykle katalizowane przez dwuchromian potasu (K.dwaCrO7) i kwas chromowy (H.dwaCrO4).
Ogólna reakcja jest następująca:
RdwaCHOH => RdwaC = O
Nomenklatura
Nazwy alkoholi drugorzędowych wskazują na pozycję grupy OH w głównym (najdłuższym) łańcuchu. Numer ten poprzedza nazwę lub może występować po nazwie odpowiedniego alkanu dla wspomnianego łańcucha.
Na przykład CH3CHdwaCHdwaCHdwaCHOHCH3, to 2-heksanol lub heksan-2-ol.
Jeśli struktura jest cykliczna, nie ma potrzeby umieszczania licznika; chyba że są inne podstawniki. Dlatego cykliczny alkohol na drugim obrazku nazywa się cykloheksanolem (pierścień jest sześciokątny).
A dla innego alkoholu tego samego obrazu (rozgałęzionego) jego nazwa to: 6-etylo-heptan-2-ol.
Aplikacje
-Jako rozpuszczalnik i półprodukt chemiczny stosuje się sec-butanol. Występuje w płynach hydraulicznych do hamulców, przemysłowych środkach czyszczących, pastach do usuwania lakieru, mineralnych środkach flotacyjnych oraz esencjach owocowych i perfumach..
-Alkohol izopropanolowy jest stosowany jako rozpuszczalnik przemysłowy i jako antykoagulant. Stosowany jest w olejach i tuszach szybkoschnących, jako środek antyseptyczny i zamiennik etanolu w kosmetykach (np. Balsamy do skóry, toniki do włosów i alkohol do wcierania).
-Izopropanol jest składnikiem mydeł w płynie, środków do czyszczenia szkła, syntetycznych aromatów w napojach bezalkoholowych i żywności. Ponadto jest to półprodukt chemiczny.
-Cykloheksanol jest stosowany jako rozpuszczalnik przy wykańczaniu tkanin, przy obróbce skóry oraz jako emulgator w mydłach i syntetycznych detergentach..
-Metylocykloheksanol jest składnikiem odplamiaczy na bazie mydła i specjalnych detergentów do tkanin.
Przykłady
2-oktanol

Jest to alkohol tłuszczowy. Jest to bezbarwna ciecz, słabo rozpuszczalna w wodzie, ale rozpuszczalna w większości niepolarnych rozpuszczalników. Znajduje zastosowanie między innymi w produkcji aromatów i zapachów, farb i powłok, tuszy, klejów, środków czystości i smarów..
Estradiol lub 17β-Estradiol

Jest to steroidowy hormon płciowy. Posiada w swojej strukturze dwie grupy hydroksylowe. Jest głównym estrogenem w okresie rozrodczym.
20-hydroksy-leukotrien
Jest to metabolit pochodzący prawdopodobnie z utleniania lipidów leukotrienów. Jest klasyfikowany jako leukotrien cystynylu. Związki te są mediatorami procesu zapalnego, który przyczynia się do patofizjologicznych cech alergicznego nieżytu nosa..
2-heptanol
Jest to alkohol występujący w owocach. Występuje również w olejku imbirowym i truskawkach. Jest przezroczysty, bezbarwny i nierozpuszczalny w wodzie. Jest używany jako rozpuszczalnik dla różnych żywic i działa w fazie flotacji w przeróbce minerałów.
Bibliografia
- James. (17 września 2014). Alkohole (1) - Nazewnictwo i właściwości. Odzyskane z: masterorganicchemistry.com
- Encyklopedia bezpieczeństwa i higieny pracy. (s.f.). Alkohole. [PDF]. Odzyskany z: insht.es
- Clark J. (16 lipca 2015). Struktura i klasyfikacja alkoholi. Chemistry Libretexts. Źródło: chem.libretexts.org
- PubChem. (2019). 20-hydroksy-leukotrien E4. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Morrison, R. T. and Boyd, R, N. (1987). Chemia organiczna. 5ta Wydanie. Od redakcji Addison-Wesley Interamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (10th wydanie.). Wiley plus.
- Wikipedia. (2018). 2-oktanol. Odzyskane z: en.wikipedia.org



Jeszcze bez komentarzy