
Alotropia Alotropowa transformacja i główne pierwiastki

Plik alotropia w chemii jest to cecha charakterystyczna, jaką mają pewne pierwiastki chemiczne, które występują w kilku różnych formach, ale w tym samym stanie skupienia materii. Struktura pierwiastków może się różnić w zależności od ich układu molekularnego i warunków, w których są tworzone, takich jak ciśnienie i temperatura..
Tylko w przypadku pierwiastków chemicznych używa się słowa alotropia, określając każdy ze sposobów, w jaki pierwiastek można znaleźć w tej samej fazie co alotrop; nie ma to zastosowania do związków wykazujących różne struktury krystaliczne; w tym przypadku nazywa się to polimorfizmem.
Znane są inne przypadki, takie jak przypadek tlenu, w którym alotropia może wystąpić jako zmiana liczby atomów substancji. W tym sensie istnieje pojęcie dwóch alotropów tego pierwiastka, które są lepiej znane jako tlen (Odwa) i ozon (O3).
Indeks artykułów
- 1 Transformacja alotropowa
- 2 Główne pierwiastki alotropowe
- 2.1 Węgiel
- 2.2 Siarka
- 2.3 Fosfor
- 2.4 Tlen
- 3 Odnośniki
Transformacja alotropowa
Jak wspomniano wcześniej, alotropy to różne sposoby, w jakie można znaleźć ten sam pierwiastek, więc ta zmiana w jego strukturze powoduje, że gatunki te pojawiają się z różnymi właściwościami fizycznymi i chemicznymi..
Podobnie przemiana alotropowa między jednym pierwiastkiem a drugim zachodzi poprzez sposób, w jaki atomy są rozmieszczone w cząsteczkach; to znaczy sposób, w jaki powstaje łącze.
Ta zmiana między jednym a drugim alotropem może nastąpić z różnych powodów, takich jak zmiany warunków ciśnienia, temperatury, a nawet częstość występowania promieniowania elektromagnetycznego, takiego jak światło..
Kiedy zmienia się struktura substancji chemicznej, może ona również zmienić swoje zachowanie, modyfikując właściwości, takie jak przewodnictwo elektryczne, twardość (w przypadku substancji stałych), temperaturę topnienia lub wrzenia, a nawet właściwości fizyczne, takie jak kolor..
Ponadto alotropia może być dwojakiego rodzaju:
- Monotropowy, gdy jedna ze struktur elementowych ma większą stabilność niż inne we wszystkich warunkach.
- Enantropiczny, gdy różne struktury są stabilne w różnych warunkach, ale mogą przekształcić się jedna w drugą w sposób odwracalny przy określonych ciśnieniach i temperaturach.
Główne pierwiastki alotropowe
Chociaż w układzie okresowym jest ponad sto znanych pierwiastków, nie wszystkie mają formy alotropowe. Najbardziej znane odmiany alotropowe przedstawiono poniżej.
Węgiel
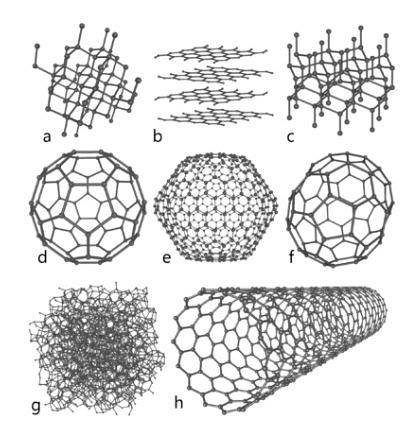
Ten występujący w przyrodzie pierwiastek stanowi fundamentalną podstawę chemii organicznej. Znanych jest kilka gatunków alotropowych, wśród których wyróżniają się diament, grafit i inne, które zostaną odsłonięte poniżej..
Diament
Diament ma układ molekularny w postaci czworościennych kryształów, których atomy są połączone pojedynczymi wiązaniami; oznacza to, że są ułożone przez hybrydyzację sp3.
Grafit
Grafit składa się z kolejnych warstw węgla, których atomy są połączone wiązaniami podwójnymi w struktury heksagonalne; to znaczy z hybrydyzacją spdwa.
Carbino
Oprócz dwóch ważnych alotropów wymienionych powyżej, które są najlepiej znanymi z węgla, istnieją inne, takie jak karbyne (znany jest również liniowy węgiel acetylenowy, LAC), w którym jego atomy są ułożone liniowo za pomocą potrójnych wiązań; to znaczy z hybrydyzacją sp.
Inni
- Grafen, którego struktura jest bardzo podobna do grafitu).
- Fuleren lub buckminsterfulleren, znany również jako buckyball, którego struktura jest sześciokątna, ale jego atomy są ułożone w kształcie pierścienia.
- Nanorurki węglowe o cylindrycznym kształcie.
- Węgiel amorficzny bez struktury krystalicznej.
Siarka
Siarka ma również kilka alotropów uważanych za powszechne, takich jak następujące (należy zauważyć, że wszystkie z nich są w stanie stałym):
Siarka rombowa
Jak sama nazwa wskazuje, jego krystaliczna struktura składa się z ośmiokątnych rombów i jest również znana jako siarka α..
Siarka jednoskośna
Znana jako β siarka, ma kształt graniastosłupa złożonego z ośmiu atomów siarki.
Stopiona siarka
Tworzy pryzmatyczne kryształy, które są stabilne w określonych temperaturach, tworząc igły pozbawione koloru..
Plastikowa siarka
Nazywana także siarką, ma amorficzną strukturę.
Ciekła siarka
Ma właściwości lepkościowe w przeciwieństwie do większości pierwiastków, ponieważ w tym alotropie rośnie wraz ze wzrostem temperatury.
Mecz
Ten niemetaliczny pierwiastek występuje powszechnie w przyrodzie w połączeniu z innymi pierwiastkami i ma kilka powiązanych substancji alotropowych:
Fosfor biały
Jest to ciało stałe o czworościennej strukturze krystalicznej i znajduje zastosowanie w wojsku, a nawet jako broń chemiczna..
Fosfor czarny
Ma najwyższą stabilność spośród alotropów tego pierwiastka i jest bardzo podobny do grafenu.
Fosfor czerwony
Tworzy bezpostaciową substancję stałą o właściwościach redukujących, ale jest pozbawiona toksyczności.
Difosfor
Jak nazwa wskazuje, składa się z dwóch atomów fosforu i jest gazową formą tego pierwiastka.
Luminofor fioletowy
Jest to ciało stałe o strukturze krystalicznej z jednoskośnym układem molekularnym..
Fosfor szkarłatny
Również stała amorficzna struktura.
Tlen
Pomimo tego, że jest jednym z najpowszechniejszych pierwiastków w ziemskiej atmosferze i jednym z najobficiej występujących we wszechświecie, ma niewiele znanych alotropów, wśród których wyróżniają się tlen i trójtlen..
Ditlen
Ditlen jest lepiej znany pod prostą nazwą tlenu, substancji gazowej niezbędnej dla procesów biologicznych na tej planecie..
Trioxygen
Trójtlen jest lepiej znany po prostu jako ozon, wysoce reaktywny alotrop, którego najbardziej znaną funkcją jest ochrona atmosfery ziemskiej przed zewnętrznymi źródłami promieniowania..
Tetraoxygen
Tworzy stałą fazę o strukturze trygonalnej z cechami metastabilności.
Inni
Istnieje również sześć innych form stałych, które tworzy tlen, o różnych strukturach krystalicznych..
W ten sam sposób istnieją pierwiastki, takie jak między innymi selen, bor, krzem, które prezentują różne alotropy i które zostały zbadane z mniejszym lub większym stopniem głębokości..
Bibliografia
- Wikipedia. (s.f.). Alotropia. Odzyskany z en.wikipedia.org
- Chang, R. (2007). Chemia, wydanie dziewiąte. Meksyk: McGraw-Hill.
- Britannica, E. (s.f.). Alotropia. Pobrane z britannica.com
- ThoughtCo. (s.f.). Definicja i przykłady alotropów. Odzyskany z thinkco.com
- Ciach, R. (1998). Zaawansowane lekkie stopy i kompozyty. Uzyskane z books.google.co.ve




Jeszcze bez komentarzy