
Właściwości, struktura, zastosowania i przykłady alkinów
Plik alkiny Są to węglowodory lub związki organiczne, które mają potrójne wiązanie między dwoma atomami węgla w swoich strukturach. To wiązanie potrójne (≡) jest uważane za grupę funkcyjną, ponieważ reprezentuje miejsce aktywne cząsteczki, a zatem jest odpowiedzialne za ich reaktywność.
Chociaż alkiny nie różnią się zbytnio od alkanów lub alkenów, wykazują większą kwasowość i polarność ze względu na charakter ich wiązań. Dokładny termin opisujący tę niewielką różnicę to tzw nienasycenie.

Alkany to węglowodory nasycone, podczas gdy alkiny są najbardziej nienasycone w stosunku do pierwotnej struktury. Co to znaczy? To alkan H.3C-CH3 (etan) można odwodornić do H.dwaC = CHdwa (eten), a później HC≡CH (etyn lub lepiej znany jako acetylen).
Zwróć uwagę, że w miarę tworzenia się dodatkowych wiązań między atomami węgla, liczba związanych z nimi wodorów maleje. Węgiel ze względu na swoje właściwości elektronowe stara się tworzyć cztery proste wiązania, więc im wyższe nienasycenie, tym większa skłonność do reagowania (z wyjątkiem związków aromatycznych).
Z drugiej strony wiązanie potrójne jest znacznie silniejsze niż wiązanie podwójne (=) lub wiązanie pojedyncze (-), ale wiąże się z wysokim kosztem energii. Stąd większość węglowodorów (alkanów i alkenów) może tworzyć potrójne wiązania w podwyższonych temperaturach..
W wyniku ich wysokiej energii, a kiedy pękają, uwalniają dużo ciepła. Przykładem tego zjawiska jest spalanie acetylenu tlenem, a intensywne ciepło płomienia jest używane do spawania lub topienia metali (górne zdjęcie).
Acetylen jest najprostszym i najmniejszym alkinem ze wszystkich. Inne węglowodory można wyrazić na podstawie ich wzoru chemicznego, podstawiając H zamiast grup alkilowych (RC≡CR '). To samo dzieje się w świecie syntezy organicznej poprzez dużą liczbę reakcji.
Ten alkin jest wytwarzany w wyniku reakcji tlenku wapnia z wapienia i koksu, surowca dostarczającego niezbędne węgle w piecu elektrycznym:
CaO + 3C => CaCdwa + WSPÓŁ
CaCdwa Jest to węglik wapnia, nieorganiczny związek, który ostatecznie reaguje z wodą, tworząc acetylen:
CaCdwa + 2HdwaO => Ca (OH)dwa + HC≡CH
Indeks artykułów
- 1 Właściwości fizyczne i chemiczne alkinów
- 1.1 Biegunowość
- 1.2 Kwasowość
- 2 Reaktywność
- 2.1 Uwodornianie
- 2.2 Dodawanie halogenowodorów
- 2.3 Nawilżenie
- 2.4 Dodawanie halogenów
- 2.5 Alkilowanie acetylenu
- 3 Struktura chemiczna
- 3.1 Odległość ogniw i końcowych alkinów
- 4 Nazewnictwo
- 5 zastosowań
- 5.1 Acetylen lub etyn
- 5.2 Naturalne alkiny
- 6 Przykłady alkinów
- 6.1 Kwas tarirowy
- 6.2 Histrionikotoksyna
- 6.3 Cyklutoksyna
- 6.4 Kapilina
- 6.5 Pargyline
- 7 Referencje
Właściwości fizyczne i chemiczne alkinów
Biegunowość
Potrójne wiązanie odróżnia alkiny od alkanów i alkenów. Te trzy rodzaje węglowodorów są niepolarne, nierozpuszczalne w wodzie i bardzo słabe kwasy. Jednak elektroujemność węgli z podwójnym i potrójnym wiązaniem jest większa niż w przypadku atomów węgla z pojedynczym wiązaniem..
Odpowiednio, węgle sąsiadujące z wiązaniem potrójnym dają ujemną gęstość ładunku przez efekt indukcyjny. Z tego powodu tam, gdzie są wiązania C≡C lub C = C, gęstość elektronów będzie wyższa niż w pozostałej części szkieletu węglowego. W konsekwencji występuje mały moment dipolowy, w którym cząsteczki oddziałują siłami dipol-dipol..
Te interakcje są bardzo słabe, jeśli porównuje się ich momenty dipolowe z momentami cząsteczki wody lub jakiegokolwiek alkoholu. Znajduje to odzwierciedlenie w ich właściwościach fizycznych: alkiny mają na ogół wyższą temperaturę topnienia i wrzenia w porównaniu z ich mniej nienasyconymi węglowodorami..
Podobnie, ze względu na niską polarność, są mniej nierozpuszczalne w wodzie, ale są rozpuszczalne w niepolarnych rozpuszczalnikach organicznych, takich jak benzen..
Kwasowość
Również ta elektroujemność powoduje wodór HC≡CR jest bardziej kwaśny niż jakikolwiek obecny w innych węglowodorach. Dlatego alkiny są bardziej kwaśnymi gatunkami niż alkeny i znacznie bardziej kwaśnymi niż alkany. Jednak jego kwasowość jest nadal znikoma w porównaniu z kwasami karboksylowymi..
Ponieważ alkiny są bardzo słabymi kwasami, reagują tylko z bardzo mocnymi zasadami, takimi jak amidek sodu:
HC≡CR + NaNHdwa => HC≡CNa + NH3
Z tej reakcji otrzymuje się roztwór acetylenku sodu, surowca do syntezy innych alkinów..
Reaktywność
Reaktywność alkinów tłumaczy się dodatkiem małych cząsteczek do ich potrójnego wiązania, zmniejszając ich nienasycenie. Mogą to być cząsteczki wodoru, halogenki wodoru, woda lub halogeny..
Uwodornienie
Mała cząsteczka H.dwa jest bardzo nieuchwytny i szybki, więc aby zwiększyć szanse na dodanie ich do potrójnego wiązania alkinów, należy zastosować katalizatory.
Są to zazwyczaj metale (Pd, Pt, Rh lub Ni) drobno rozdrobnione w celu zwiększenia powierzchni; a więc kontakt między wodorem i alkinem:
RC≡CR '+ 2Hdwa => RCHdwaCHdwaR '
W rezultacie wodór jest „zakotwiczony” do atomów węgla, przerywając wiązanie i tak dalej, aż do wytworzenia odpowiedniego alkanu, RCHdwaCHdwaR '. To nie tylko nasyca początkowy węglowodór, ale także modyfikuje jego strukturę molekularną..
Dodawanie halogenków wodoru
Tutaj dodaje się nieorganiczną cząsteczkę HX, gdzie X może oznaczać dowolny z halogenów (F, Cl, Br lub I):
RC≡CR '+ HX => RCH = CXR'
Uwodnienie
Uwodnienie alkinów polega na dodaniu cząsteczki wody do aldehydu lub ketonu:
RC≡CR '+ HdwaO => RCHdwaCOR ”
Jeśli R 'oznacza H, jest to aldehyd; jeśli jest to alkil, to jest to keton. W reakcji jako półprodukt tworzy się związek znany jako enol (RCH = C (OH) R ')..
To ulega konwersji z formy enolowej (C-OH) do postaci ketonowej (C = O) w równowadze zwanej tautomeryzacją.
Dodawanie halogenów
A jeśli chodzi o dodatki, dwuatomowe cząsteczki halogenów (Xdwa= F.dwa, Cldwa, Brdwa słyszałemdwa):
RC≡CR '+ 2Xdwa => RCXdwa-CXdwaR '
Alkilowanie acetylenu
Inne alkiny można wytworzyć z roztworu acetylenku sodu przy użyciu halogenku alkilu:
HC≡CNa + RX => HC≡CR + NaX
Na przykład, gdyby był to jodek metylu, otrzymany alkin byłby:
HC≡CNa + CH3I => HC≡CCH3 + NaX
HC≡CCH3 to wskazówka, znana również jako metylacetylen.
Struktura chemiczna
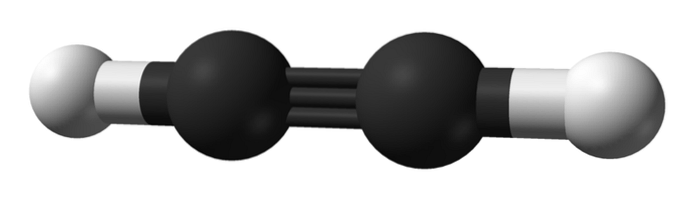
Jaka jest struktura alkinów? Na górnym obrazku pokazano cząsteczkę acetylenu. Na tej podstawie można wyraźnie zaobserwować liniową geometrię wiązania C EnlaceC.
Dlatego tam, gdzie występuje wiązanie potrójne, struktura cząsteczki powinna być liniowa. To kolejna z zauważalnych różnic między nimi a pozostałymi węglowodorami.
Alkany są zwykle przedstawiane jako zygzaki, ponieważ mają hybrydyzację sp3 a ich linki są oddalone od siebie o 109º. W rzeczywistości są łańcuchem kowalencyjnie połączonych czworościanów. Podczas gdy alkeny są płaskie przez hybrydyzację spdwa atomów węgla, a dokładniej tworząc płaszczyznę trygonalną z wiązaniami oddzielonymi o 120º.
W alkinach hybrydyzacja orbitalna jest sp, to znaczy mają charakter 50% s i charakter 50% p. Istnieją dwa orbitale hybrydowe sp, które wiążą się z atomami H w acetylenie lub z grupami alkilowymi w alkinach..
Odległość między dwoma H lub R wynosi 180º, oprócz tego, że tylko w ten sposób czyste orbitale p atomów węgla mogą tworzyć wiązanie potrójne. Z tego powodu wiązanie -C≡C- jest liniowe. Patrząc na strukturę dowolnej cząsteczki, -C≡C- wyróżnia się w tych regionach, w których szkielet jest bardzo liniowy.
Odległość łączy i końcowych alkinów
Węgle w wiązaniu potrójnym są bliżej siebie niż w wiązaniu podwójnym lub pojedynczym. Innymi słowy, C≡C jest krótsze niż C = C i C-C. W konsekwencji wiązanie jest silniejsze, ponieważ dwa wiązania π pomagają ustabilizować pojedyncze wiązanie σ..
Jeśli potrójne wiązanie znajduje się na końcu łańcucha, jest to terminal alkinowy. Dlatego formuła tego związku musi być HC≡CR, gdzie H podkreśla koniec lub początek łańcucha.
Jeśli przeciwnie, jest to wewnętrzne wiązanie potrójne, wzór to RC≡CR ', gdzie R i R' to prawa i lewa strona łańcucha.
Nomenklatura
Jak nazywa się alkiny zgodnie z zasadami dyktowanymi przez IUPAC? W taki sam sposób, jak nazwano alkanów i alkenów. Aby to zrobić, przyrostek -ano lub -eno jest zamieniany na przyrostek -ino.
Na przykład: HC≡CCH3 nazywa się propyn, ponieważ ma trzy atomy węgla, podobnie jak propan (CH3CHdwaCH3). HC≡CCHdwaCH3 to 1-butyn, który jest terminalnym alkinem. Ale w przypadku CH3C≡CCH3 jest to 2-butyn, w którym potrójne wiązanie nie jest końcowe, ale wewnętrzne.
CH3C≡CCHdwaCHdwa(CH3)dwa oznacza 5-metylo-2-heksyn. Węgle liczone są od strony najbliższej wiązaniu potrójnemu.
Innym rodzajem alkinów są cykloalkiny. Dla nich wystarczy zastąpić przyrostek -ano przez -ino odpowiedniego cykloalkanu. Tak więc cyklopropan, który ma potrójne wiązanie, nazywa się cyklopropino (który nie istnieje).
W przypadku dwóch wiązań potrójnych do nazwy dodawany jest przedrostek di-. Przykładami są HC≡C-C≡H, diacetylen lub propadino; i HC≡C-C-C≡H, butadiino.
Aplikacje
Acetylen lub etyn
Najmniejszy z alkinów zagęszcza możliwą liczbę zastosowań tych węglowodorów. Stąd poprzez alkilacje można syntetyzować inne związki organiczne. Podobnie ulega reakcjom utleniania, aby otrzymać między innymi etanol, kwas octowy, kwas akrylowy..
Inne jego zastosowania obejmują dostarczanie źródła ciepła do wzbudzania elektronów atomów; a dokładniej kationów metali w oznaczeniach absorpcji i emisji atomowej, szeroko stosowanej techniki spektroskopowej.
Naturalne alkiny
Jedyne istniejące metody otrzymywania alkinów to nie tylko syntetyczne lub z zastosowaniem ciepła przy braku tlenu, ale także biologiczne.
Te wykorzystują enzymy zwane acetylenazy, które mogą odwodorniać wiązanie podwójne. Dzięki temu uzyskuje się wiele naturalnych źródeł alkinów.
W rezultacie trucizny, odtrutki, leki lub jakikolwiek inny związek, który zapewnia pewne korzyści, można wyodrębnić z tych źródeł; zwłaszcza gdy dotyczy zdrowia. Istnieje wiele alternatyw w przypadku modyfikowania ich pierwotnych struktur i wykorzystywania ich jako wsparcia dla nowych alkinów..
Przykłady alkinów
Do tej pory wymieniono liczne przykłady alkinów. Jednak niektóre pochodzą z bardzo specyficznych źródeł lub mają określoną strukturę molekularną: są to poliacetyleny.
Oznacza to, że może istnieć więcej niż jedno wiązanie potrójne, które jest częścią bardzo dużej struktury, a nie tylko prosty łańcuch węglowy..
Kwas tarirowy

Kwas tarirowy pochodzi z rośliny znajdującej się w Gwatemali o nazwie Picramnia tariri. Jest specjalnie pozyskiwany z oleju z jego nasion.
W jego strukturze molekularnej można zaobserwować pojedyncze potrójne wiązanie, które oddziela apolarny ogon od polarnej głowy; dlatego można go uznać za cząsteczkę amfipatyczną.
Histrionicotoxin
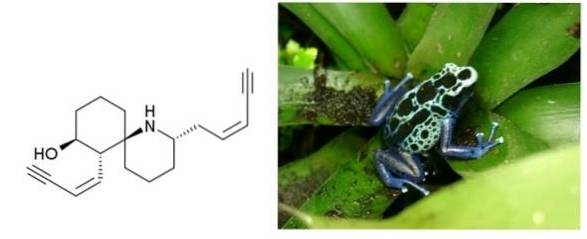
pod adresem en.wikipedia [domena publiczna], źródło Wikimedia Commons
Histrionikotoksyna to trucizna wydzielana przez skórę żab zamieszkujących Kolumbię, Brazylię i inne kraje Ameryki Łacińskiej. Ma dwa potrójne wiązania sprzężone z jednym podwójnym wiązaniem. Obie są końcowe i oddzielone sześciowęglowym pierścieniem i cykliczną aminą..
Cicutoxin
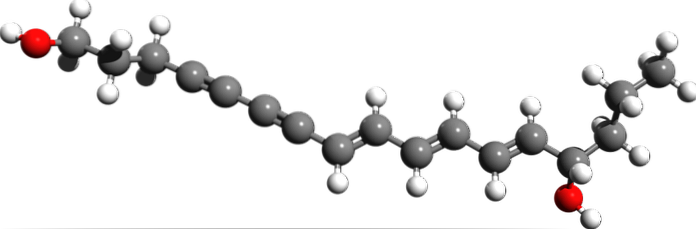
Ze struktury molekularnej cykutoksyny, gdzie są wiązania potrójne? Jeśli wiązania podwójne są płaskie, jak widać po prawej stronie, a wiązania pojedyncze są czworościenne, jak na końcach, trójki są liniowe i znajdują się na nachyleniu (\).
Związek ten składa się z neurotoksyny występującej głównie w wodnej roślinie cykuty..
Capillina
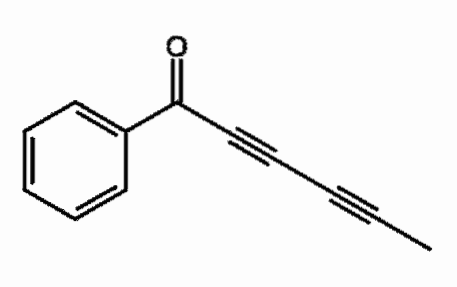
Jest to alkin obecny w olejku eterycznym z bylicy, który jest stosowany jako środek przeciwgrzybiczy. Można zaobserwować dwa kolejne potrójne wiązania, bardziej poprawnie skoniugowane.
Co to znaczy? Te potrójne wiązania rezonują w całym łańcuchu węglowym i obejmują otwarcie wiązania podwójnego C = O do C-O-.
Pargyline
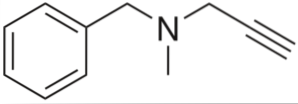
Jest to alkin o działaniu przeciwnadciśnieniowym. Analizując jego strukturę w podziale na części, mamy: grupę benzylową po lewej stronie, trzeciorzędową aminę pośrodku i propynyl po prawej; to znaczy terminalną grupę propynową.
Bibliografia
- Francis A. Carey. Chemia organiczna. Kwasy karboksylowe. (wyd. szóste, str. 368-397). Mc Graw Hill.
- Brennan, John. (10 marca 2018). Przykłady alkinów. Nauka. Zaczerpnięte z: sciencing.com
- BYJU. (2018). Potrójne wiązanie w alkinach. Zaczerpnięte z: byjus.com
- Encyklopedia przykładów (2017). Alkiny. Odzyskany z: examples.co
- Kevin A. Boudreaux. Alkiny. Zaczerpnięte z: angelo.edu
- Robert C. Neuman, Jr. Alkenes and Alkynes. [PDF]. Zaczerpnięte z: chem.ucr.edu



Jeszcze bez komentarzy