
Historia, właściwości, struktura, zastosowania boru
Plik bor Jest to pierwiastek niemetaliczny, który stoi na czele grupy 13 układu okresowego i jest reprezentowany przez symbol chemiczny B. Jego liczba atomowa wynosi 5 i jest jedynym pierwiastkiem niemetalicznym w swojej grupie; chociaż niektórzy chemicy uważają go za metaloid.
Pojawia się jako czarnobrązowy proszek i występuje w proporcji 10 ppm w stosunku do skorupy ziemskiej. Dlatego nie jest jednym z najbardziej rozpowszechnionych elementów.

Występuje jako część kilku minerałów, takich jak boraks lub boran sodu, jest to najpowszechniejszy minerał boru. Istnieje również kurnit, inna forma boranu sodu; kolemanit lub boran wapnia; i uleksyt, boran sodu i wapnia.
Borany są wydobywane w Stanach Zjednoczonych, Tybecie, Chinach i Chile, a światowa produkcja wynosi około dwóch milionów ton rocznie.
Ten pierwiastek ma trzynaście izotopów, z których jest najwięcej jedenaścieB, który stanowi 80,1% masy boru oraz 10B, co stanowi pozostałe 19,9%.
Bor jest niezbędnym pierwiastkiem śladowym dla roślin, uczestniczy w syntezie niektórych ważnych białek roślinnych i przyczynia się do wchłaniania wody. Wydaje się, że u ssaków jest to niezbędne dla zdrowia kości.
Chociaż bor został odkryty w 1808 roku przez angielskiego chemika Sir Humphry'ego Davy'ego oraz francuskich chemików Jacquesa Thérnarda i Josepha Gay-Lussaca, od początku naszej ery w Chinach boraks był używany do produkcji ceramiki emaliowanej.
Bor i jego związki mają wiele zastosowań i zastosowań, począwszy od konserwowania żywności, zwłaszcza margaryny i ryb, po zastosowanie w leczeniu guzów nowotworowych mózgu, pęcherza, prostaty i innych narządów..
Bor jest słabo rozpuszczalny w wodzie, ale jego związki są. Może to być mechanizm koncentracji boru, a także źródło zatrucia pierwiastkiem..
Indeks artykułów
- 1 Historia
- 1.1 Tło
- 1.2 Odkrycie pierwiastków
- 1.3 Identyfikacja i izolacja
- 2 Właściwości
- 2.1 Opis fizyczny
- 2.2 Masa molowa
- 2.3 Temperatura topnienia
- 2.4 Temperatura wrzenia
- 2.5 Gęstość
- 2.6 Ciepło topnienia
- 2.7 Ciepło parowania
- 2,8 Molowa pojemność cieplna
- 2.9 Energia jonizacji
- 2.10 Elektroujemność
- 2.11 Promień atomowy
- 2.12 objętość atomowa
- 2.13 Przewodność cieplna
- 2.14 Oporność elektryczna
- 2.15 Twardość
- 2.16 Reaktywność
- 3 Struktura i konfiguracja elektronowa boru
- 3.1 Ogniwa i jednostki strukturalne w borze
- 3,2 α-romboedryczny bor
- 3,3 β-romboedryczny bor
- 3.4 Sól kamienna boru-γ
- 3,5 Sześcienny i bezpostaciowy
- 3.6 Borofenes
- 3.7 Konfiguracja elektroniczna
- 4 Otrzymywanie
- 5 zastosowań
- 5.1 W przemyśle
- 5.2 W medycynie
- 5.3 Działanie biologiczne
- 6 Zagrożenia i środki ostrożności
- 7 Referencje
Fabuła
tło
Od najdawniejszych czasów człowiek do różnych czynności wykorzystywał związki boru. Boraks, minerał znany jako tincal, był używany w Chinach w 300 rne. w produkcji ceramiki emaliowanej.
Po raz pierwszy o związkach boru wspomniał perski alchemik Rhazes (865-925). Rhazes podzielił minerały na sześć klas, z których jedną stanowiły boracios zawierające bor.
Agricola, około 1600 roku, poinformował o użyciu boraksu jako topnika w metalurgii. W 1777 roku stwierdzono obecność kwasu borowego w gorącym źródle w pobliżu Florencji.
Odkrywanie pierwiastków
Humphry Davy, poprzez elektrolizę roztworu boraksu, zaobserwował gromadzenie się czarnego osadu na jednej z elektrod. Ogrzał również tlenek boru (B.dwaLUB3) z potasem, tworząc czarnobrązowy proszek, który był znaną formą boru.
Gay-Lussac i Thénard zredukowali kwas borowy w wysokich temperaturach w obecności żelaza do produkcji boru. Pokazali również proces odwrotny, to znaczy, w którym kwas borowy jest produktem utleniania boru.
Identyfikacja i izolacja
Jöns Jakob Berzelius (1827) zidentyfikował bor jako nowy pierwiastek. W 1892 roku francuski chemik Henri Moissan zdołał wyprodukować bor o czystości 98%. Chociaż wskazuje się, że bor został wyprodukowany w czystej postaci przez amerykańskiego chemika Ezekiela Weintrauba w roku 1909.
Nieruchomości
Opis fizyczny
Krystaliczny stały lub bezpostaciowy czarno-brązowy proszek.
Masa cząsteczkowa
10,821 g / mol.
Temperatura topnienia
2076 ºC.
Temperatura wrzenia
3927 ºC.
Gęstość
-Ciecz: 2,08 g / cm3.
-Krystaliczny i bezpostaciowy w temperaturze 20 ° C: 2,34 g / cm3.
Ciepło topnienia
50,2 kJ / mol.
Ciepło parowania
508 kJ / mol.
Molowa pojemność cieplna
11,087 J / (mol K)
Energia jonizacji
-Poziom pierwszy: 800,6 kJ / mol.
-Drugi poziom: 2427 kJ / mol.
-Trzeci poziom: 3659,7 kJ / mol.
Elektroujemność
2,04 w skali Paulinga.
Radio atomowe
90 po południu (empirycznie).
Objętość atomowa
4,16 cm3/ mol.
Przewodność cieplna
27,4 W / m.K
Rezystancja
~ 106 Ω.m (przy 20ºC).
Bor w wysokich temperaturach jest dobrym przewodnikiem elektrycznym, ale w temperaturze pokojowej staje się prawie izolatorem.
Twardość
~ 9,5 w skali Mohsa.
Reaktywność
Bor nie ulega działaniu kwasu solnego w temperaturze wrzenia. Jednak jest przekształcany przez gorący kwas azotowy w kwas borowy (H3BO3). Bor zachowuje się chemicznie jak niemetal.
Reaguje ze wszystkimi halogenami, dając wysoce reaktywne trihalogenki. Mają one ogólny wzór BX3, gdzie X oznacza halogen.
Łączy się z różnymi pierwiastkami, tworząc borki. Niektóre z nich należą do najtwardszych substancji; na przykład azotek boru (BN). Bor łączy się z tlenem, tworząc trójtlenek boru.
Struktura i konfiguracja elektronowa boru
Ogniwa i jednostki strukturalne w borze
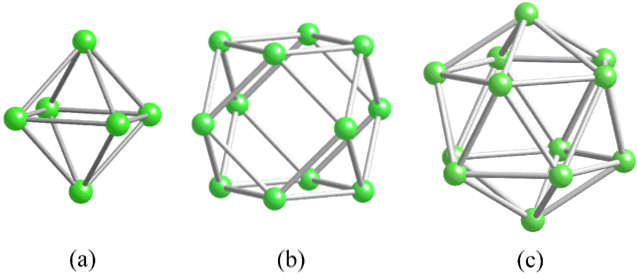
Przed zajęciem się strukturą boru (krystaliczną lub bezpostaciową) należy koniecznie pamiętać, w jaki sposób można połączyć jego atomy. Wiązanie B-B jest zasadniczo kowalencyjne; Nie tylko to, ale ponieważ atomy boru naturalnie wykazują niedobór elektroniki, będą próbować dostarczać go w swoich wiązaniach w taki czy inny sposób..
W borze obserwuje się szczególny rodzaj wiązania kowalencyjnego: to z trzema centrami i dwoma elektronami, 3c2e. Tutaj trzy atomy boru dzielą dwa elektrony i definiują trójkąt, jedną z wielu ścian znajdujących się w ich strukturalnych wielościanach (górne zdjęcie).
Od lewej do prawej mamy: ośmiościan (a, B6), kuboktaedr (b, B.12) i izocashedron (c, B12 również). Wszystkie te jednostki mają jedną cechę: są ubogie w elektrony. Dlatego mają tendencję do łączenia się kowalencyjnie ze sobą; a rezultatem jest partia niesamowitych linków.
W każdym trójkącie tych wielościanów występuje wiązanie 3c2e. W przeciwnym razie nie można byłoby wyjaśnić, w jaki sposób bor, zdolny do tworzenia tylko trzech wiązań kowalencyjnych zgodnie z teorią wiązań Walencji, może mieć do pięciu wiązań w tych jednostkach wielościennych..
Struktury borowe składają się następnie z ułożenia i powtórzenia tych jednostek, które ostatecznie określają kryształ (lub amorficzną substancję stałą).
Bor Α-romboedryczny
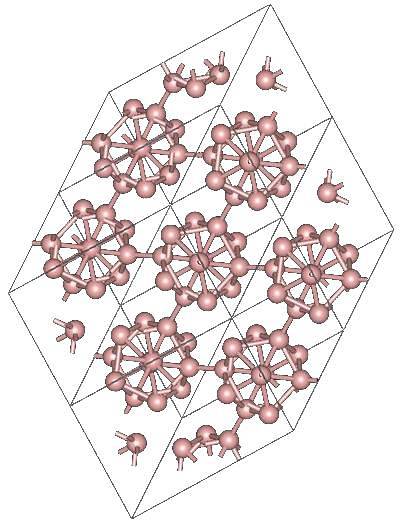
Mogą istnieć inne wielościenne jednostki boru, jak również jedna złożona tylko z dwóch atomów, B.dwa; „linia” boru, która musi być związana z innymi atomami ze względu na wysoki niedobór elektronów.
Dwudziestościan jest zdecydowanie preferowaną jednostką boru; ten, który najbardziej Ci odpowiada. Na powyższym obrazku, na przykład, możesz zobaczyć, jak te jednostki B.12 przeplatają się, aby zdefiniować romboedryczny kryształ boru-α.
Gdybyś chciał wyodrębnić jeden z tych dwudziestościanów, byłoby to skomplikowane zadanie, ponieważ jego elektroniczny niedobór zmusza ich do zdefiniowania kryształu, w którym każdy dostarcza elektrony potrzebne innym sąsiadom..
Bor Β-romboedryczny
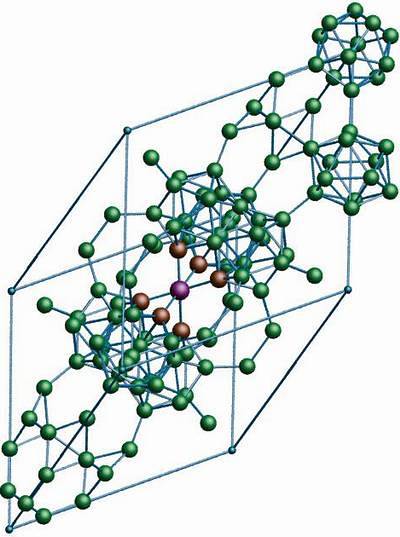
Alotropowy bor β-romboedryczny, jak już wskazuje jego nazwa, ma romboedryczne kryształy, takie jak bor-α; jednak różni się pod względem jednostek strukturalnych. Wygląda jak obcy statek zbudowany z atomów boru.
Jeśli przyjrzysz się uważnie, jednostki ikosaedryczne można zobaczyć w dyskretny i zespolony sposób (w środku). Istnieją również jednostki B.10 oraz pojedyncze atomy boru, które działają jako pomost dla wymienionych jednostek. Ze wszystkich jest to najbardziej stabilny alotrop boru.
Sól kamienna boru-γ
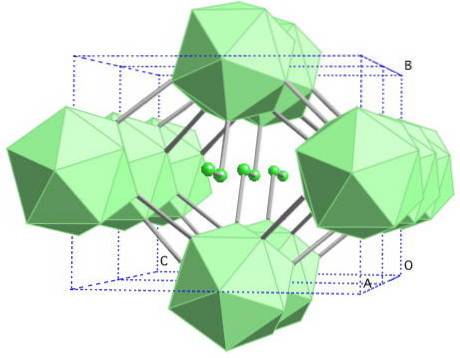
W tym alotropie boru jednostki B są skoordynowanedwa oraz b12. Bdwa jest tak wadliwa elektronicznie, że faktycznie usuwa elektrony z B.12 i dlatego w tym ciele stałym istnieje charakter jonowy. Oznacza to, że są one nie tylko związane kowalencyjnie, ale występuje przyciąganie elektrostatyczne typu [B.dwa-] [B12+].
Bor-γ krystalizuje do struktury soli kamiennej, takiej samej jak w przypadku NaCl. Uzyskuje się go poddając inne alotropy boru działaniu wysokiego ciśnienia (20 GPa) i temperatur (1800 ° C), aby później zachować stabilność w normalnych warunkach. Jego stabilność faktycznie konkuruje ze stabilnością β-romboedrycznego boru.
Sześcienny i amorficzny
Inne alotropy boru składają się z agregatów atomów B, tak jakby były połączone wiązaniem metalicznym lub jakby były kryształami jonowymi; to znaczy jest to bor sześcienny.
Nie mniej ważny jest również bor amorficzny, w którym rozmieszczone są jednostki B.12 to jest przypadkowe i niechlujne. Pojawia się jako szklisty stały lub drobny proszek o matowo brązowych i ciemnych kolorach.
Borofenes
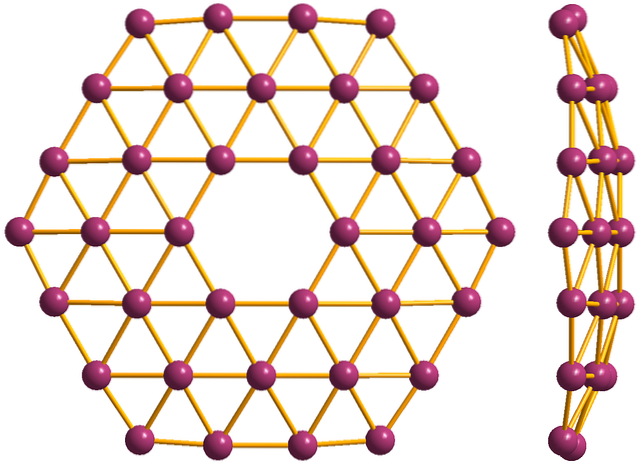
I wreszcie najnowszy i najdziwniejszy alotrop boru: borofen (górne zdjęcie). Składa się z monowarstwy atomów boru; niezwykle cienki i analogiczny do grafenu. Zauważ, że zachowuje słynne trójkąty, charakterystyczne dla deficytu elektronicznego, na który cierpią jego atomy.
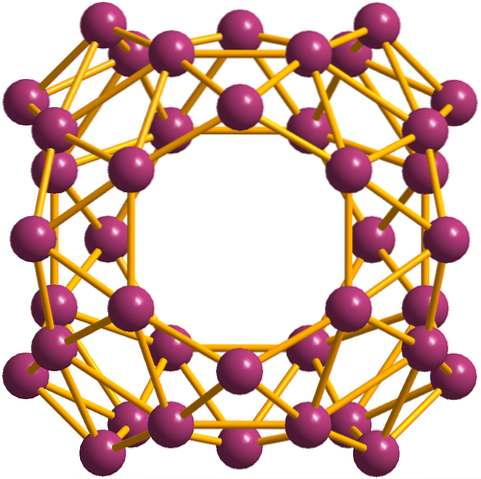
Oprócz borofenów, z których B.36 jest najprostszy i najmniejszy, są też skupiska boru. Borosfera (zdjęcie poniżej) składa się z kulistej kulistej klatki złożonej z czterdziestu atomów boru, B40; ale zamiast gładkich krawędzi są ostre i postrzępione:
Elektroniczna Konfiguracja
Konfiguracja elektronowa boru to:
[On] 2sdwa 2 P1
Dlatego ma trzy elektrony walencyjne. Potrzeba jeszcze pięciu, aby zakończyć swój oktet walencyjny, i ledwo może utworzyć trzy wiązania kowalencyjne; potrzebowałby czwartego linku celownika, aby ukończyć swój oktet. Bor może stracić swoje trzy elektrony, aby uzyskać stopień utlenienia +3.
Otrzymywanie
Bor wydziela się przez redukcję kwasu borowego za pomocą magnezu lub glinu; metoda podobna do zastosowanej przez Gay-Lussaca i Thénarda. Ma trudność w zanieczyszczeniu boru borkami tych metali.
Próbkę o wysokiej czystości można otrzymać przez redukcję w fazie gazowej trójchlorku boru lub trójbromku wodoru na ogrzewanych elektrycznie włóknach tantalu..
Bor o wysokiej czystości otrzymywany jest poprzez rozkład diboranu w wysokiej temperaturze, a następnie oczyszczanie metodą syntezy strefowej lub procesem Czocharalskiego..
Aplikacje
W przemyśle
Do hartowania stali zastosowano bor pierwiastkowy. W stopie z żelazem zawierającym 0,001 do 0,005% boru. Jest również stosowany w przemyśle nieżelaznym, zwykle jako odtleniacz.
Ponadto bor jest stosowany jako odgazowywacz miedzi o wysokiej przewodności i stopów na bazie miedzi. W przemyśle półprzewodników ostrożnie dodaje się niewielkie ilości boru jako domieszki krzemu i germanu..
Tlenek boru (B.dwaLUB3) miesza się z krzemionką, aby uzyskać szkło żaroodporne (szkło borokrzemianowe), używane w naczyniach kuchennych i niektórych urządzeniach laboratoryjnych.
Węglik boru (B.4C) to niezwykle twarda substancja stosowana jako środek ścierny i wzmacniający w materiałach kompozytowych. Borek glinu (AlB12) jest stosowany jako substytut pyłu diamentowego do szlifowania i polerowania.
Bor jest stosowany w stopach, na przykład magnesach ziem rzadkich, poprzez tworzenie stopów żelaza i neodymu. Uformowane magnesy są wykorzystywane do produkcji mikrofonów, przełączników magnetycznych, słuchawek i akceleratorów cząstek.
W medycynie
Pojemność izotopu boru-10 (10B) do wychwytywania neutronów, w leczeniu guzów mózgu metodą znaną jako Boron Neutron Capture Therapy (BNCT) zastosowano promieniowanie typu α.
Plik 10Związek B gromadzi się w guzie nowotworowym. Następnie obszar guza naświetlany jest neutronami. Te współdziałają z 10B, co powoduje emisję cząstek α. Cząsteczki te mają wysoki względny efekt biologiczny i ze względu na ich duży rozmiar mają niewielki zasięg..
Dlatego destrukcyjne działanie cząstek α pozostaje uwięzione w komórkach nowotworowych, prowadząc do ich zniszczenia. BNCT jest również stosowany w leczeniu guzów nowotworowych szyi, wątroby, pęcherza i prostaty..
Działanie biologiczne
Do wzrostu wielu roślin potrzebna jest niewielka ilość boru w postaci kwasu borowego lub boranu. Niedobór boru objawia się zniekształconym wzrostem roślin; „brązowe serce” warzyw; oraz „sucha zgnilizna” buraków cukrowych.
Bor może być potrzebny w niewielkich ilościach, aby zachować zdrowie kości. Istnieją badania, które wskazują, że brak boru byłby zaangażowany w powstawanie zapalenia stawów. Ingerowałby również w funkcje mózgu, takie jak pamięć i koordynacja ręka-oko.
Niektórzy eksperci zwracają uwagę, że w codziennej diecie powinno znaleźć się od 1,5 do 3 mg boru.
Ryzyko i ostrożność
Bor, tlenek boru, kwas borowy i borany są uważane za nietoksyczne. LD50 dla zwierząt wynosi 6 g boru / kg masy ciała, podczas gdy substancje o wartości LD50 większej niż 2 g / kg masy ciała są uważane za nietoksyczne..
Z drugiej strony, spożywanie więcej niż 0,5 mg boru dziennie przez 50 dni powoduje drobne problemy trawienne, sugerujące toksyczność. Niektóre doniesienia wskazują, że nadmierne spożycie boru może wpływać na funkcjonowanie żołądka, wątroby, nerek i mózgu.
Zgłaszano również krótkotrwałe działanie drażniące na nosogardziel, górne drogi oddechowe i oczy w wyniku narażenia na bór..
Doniesienia o toksyczności boru są nieliczne, aw wielu przypadkach toksyczność występuje przy bardzo wysokich dawkach, wyższych niż te, na które narażona jest ogólna populacja..
Zaleca się monitorowanie zawartości boru w żywności, zwłaszcza w warzywach i owocach. Rządowe agencje zdrowia muszą zapewnić, że stężenie boru w wodzie nie przekracza dozwolonych limitów..
Pracownicy narażeni na działanie pyłu zawierającego bor powinni nosić maski, rękawice i specjalne obuwie chroniące drogi oddechowe..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Alotropy boru. Odzyskane z: en.wikipedia.org
- Prof. Robert J. Lancashire. (2014). Wykład 5b. Struktura pierwiastków (niemetale, B, C). Wydział Chemii, University of the West Indies, Mona Campus, Kingston 7, Jamajka. Odzyskany z: chem.uwimona.edu.jm
- Manisha Lalloo. (28 stycznia 2009). Odkryto ultra czystą strukturę boru. Świat chemii. Źródło: chemistryworld.com
- Bell Terence. (16 grudnia 2018). Profil z boru metalowego. Odzyskany z: thebalance.com
- Redaktorzy Encyclopaedia Britannica. (2019). Bor. Odzyskany z: britannica.com
- Agencja ds. Substancji Toksycznych i Rejestru Chorób. (2010). ToxFAQs ™ na borze. [PDF]. Odzyskany z: atsdr.cdc.gov
- Helmenstine, dr Anne Marie (6 lutego 2019). Właściwości chemiczne i fizyczne boru. Odzyskany z: thinkco.com



Jeszcze bez komentarzy