
Budowa, funkcje i mechanizm działania kalmoduliny
Kalmodulina to termin oznaczający „białko modulowane wapniem” i odnosi się do małego białka wewnątrzkomórkowego, które ma właściwość wiązania jonu wapnia (Ca ++) i pośredniczenia w wielu jego działaniach wewnątrzkomórkowych. Pochodzenie tego słowa pochodzi z połączenia angielskich słów „wapń”, „modulowany” i „białko”, które razem wzięte LIMONKAcium MODUŁated proteW.
Spośród pierwiastków mineralnych, które stają się częścią składową organizmów zwierzęcych, zdecydowanie najobficiej występuje wapń, a następnie fosfor, ponieważ kość powstaje w wyniku odkładania się w jej macierzy dużych ilości soli mineralnych powstałych z tego jonu.

Oczywiście te mineralne sole wapnia są niezbędne dla budowy i budowy układu kostnego kręgowców, ale to zjonizowana forma wapnia (Ca ++) w roztworze w płynach ustrojowych nabiera odpowiedniego fizjologicznego znaczenia dla życia zwierzęta, organizmy.
Ten kation, z dwoma dodatnimi dodatnimi ładunkami elektrycznymi w swojej strukturze, może działać jako nośnik prądu, przemieszczając się przez błonę komórkową i modyfikując jego poziom potencjału elektrycznego w wielu pobudliwych komórkach ciała, głównie w mięśniu sercowym..
Jednak większe znaczenie fizjologiczne ma fakt, że wiele komórkowych reakcji regulacyjnych wyzwalanych przez bodźce zewnętrzne, takie jak neuroprzekaźniki, hormony lub inne czynniki fizyczne lub biochemiczne, to gatunki kaskad metabolicznych, w których uczestniczy kolejno kilka białek, z których część to enzymy wymagające wapń do aktywacji lub inaktywacji.
Mówi się więc w tych przypadkach, że wapń działa jako drugi przekaźnik w kaskadzie metabolicznej, której celem jest uzyskanie końcowego rezultatu, który będzie podobny do odpowiedzi komórkowej niezbędnej do zaspokojenia potrzeby wykrytej na innym poziomie, różnym od poziomu samej komórki, i że wymaga od niej tej konkretnej odpowiedzi.
Wapń może oddziaływać bezpośrednio na swój cel biochemiczny, wpływając na jego aktywność, ale często wymaga udziału białka, z którym musi się wiązać, aby wywrzeć wpływ na modyfikowane białko (białka). Kalmodulina jest jednym z tych białek mediatorów.
Indeks artykułów
- 1 Struktura
- 2 Funkcje kalmoduliny
- 3 Mechanizm działania
- 3.1 Kalmodulina i skurcze mięśni gładkich
- 3.2 Adaptacja w czujnikach węchowych
- 4 Kalmodulina w roślinach
- 5 Referencje
Struktura
Kalmodulina, wysoce wszechobecna, ponieważ jest wyrażana w prawie wszystkich typach komórek organizmów eukariotycznych, jest niewielkim kwaśnym białkiem o masie cząsteczkowej około 17 kDa, którego struktura jest silnie konserwowana wśród gatunków..
Jest to białko monomeryczne, to znaczy składa się z pojedynczego łańcucha polipeptydowego, który na swoich końcach przyjmuje postać domen globularnych połączonych alfa helisą. Każda domena kulista ma dwa motywy znane jako ręka EF. EF dłoń), które są typowe dla białek wiążących wapń.
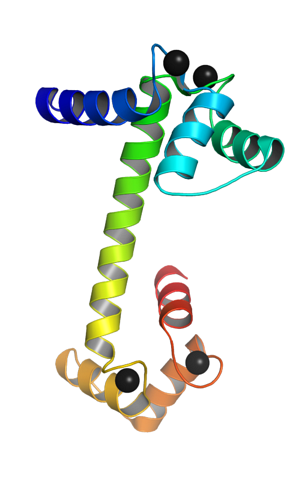
Te motywy topologiczne „dłoni EF” reprezentują rodzaj struktur nadwykonawczych; są połączone ze sobą, w każdej domenie kulistej, regionem o dużej elastyczności, aw każdym z nich znajduje się miejsce wiązania Ca ++, co daje łącznie 4 miejsca dla każdej cząsteczki kalmoduliny.
Wiązanie dodatnio naładowanych jonów wapnia jest możliwe dzięki obecności reszt aminokwasowych z ujemnie naładowanymi łańcuchami bocznymi w miejscach wiązania wapnia kalmoduliny. Te pozostałości to trzy asparaginiany i jeden glutaminian..
Funkcje kalmoduliny
Wszystkie dotychczas znane funkcje kalmoduliny mieszczą się w grupie działań promowanych przez wzrost cytozolowego wapnia wytwarzanego przez jego wejście z przestrzeni zewnątrzkomórkowej lub jego wyjście ze złogów wewnątrzkomórkowych: mitochondria i retikulum endoplazmatyczne.
Wiele działań wapnia jest wykonywanych przez ten jon, działając bezpośrednio na jego białka docelowe, które mogą mieć różne typy i funkcje. Na niektóre z tych białek nie można bezpośrednio wpływać, ale wymagają one wapnia do wiązania kalmoduliny i to właśnie ten kompleks działa na białko, na które wpływa jon..
Mówi się, że te białka docelowe są zależne od wapnia i kalmoduliny i obejmują dziesiątki enzymów, takich jak kinazy białkowe, fosfatazy białkowe, cyklazy nukleotydów i fosfodiesterazy; wszystkie zaangażowane w niezliczone funkcje fizjologiczne, w tym:
- Metabolizm
- Transport cząstek
- Mobilność trzewna
- Wydzielanie substancji
- Zapłodnienie zalążków
- Ekspresja genu
- Proliferacja komórek
- Integralność strukturalna komórek
- Komunikacja międzykomórkowa itp.
Do kinaz białkowych zależnych od kalmoduliny należą: kinaza łańcucha lekkiego miozyny (MLCK), kinaza fosforylazy i kinazy Ca ++ / kalmoduliny I, II i III.
Zatem informacja kodowana przez sygnały wapnia (wzrost lub spadek jego wewnątrzkomórkowego stężenia) jest „dekodowana” przez to i inne białka wiążące wapń, które przekształcają sygnały w zmiany biochemiczne; Innymi słowy, kalmodulina jest białkiem pośrednim w zależnych od wapnia procesach sygnalizacyjnych.
Mechanizm akcji
Kalmodulina jest bardzo wszechstronnym białkiem, ponieważ jej „docelowe” białka są bardzo zróżnicowane pod względem kształtu, sekwencji, wielkości i funkcji. Ponieważ jest to białko, które działa jako „czujnik” jonów wapnia, jego mechanizm działania zależy od zmian wywołanych w jego strukturze i / lub konformacji po związaniu się z czterema z tych jonów..
Jego mechanizmy działania można zilustrować na przykładzie krótkiego przeglądu jego udziału w kilku procesach fizjologicznych, takich jak skurcz mięśni gładkich trzewnych i adaptacja do zapachów wydzielanych przez komórki rzęsate śluzówki węchowej nosa..
Skurcz kalmoduliny i mięśni gładkich
Skurcz mięśnia szkieletowego i mięśnia sercowego jest wyzwalany, gdy wzrost cytozolowego Ca ++ osiąga poziom powyżej 10-6 mol / l, a jon ten wiąże się z troponiną C, która podlega allosterycznym zmianom wpływającym na tropomiozynę. Z kolei tropomiozyna porusza się i odsłania swoje miejsca wiązania miozyny w aktynie, co powoduje uruchomienie procesu skurczu.
Troponina C nie występuje w mięśniach gładkich, a wzrost Ca ++ powyżej wskazanego poziomu sprzyja jej wiązaniu z kalmoduliną. Kompleks Ca-kalmoduliny aktywuje kinazę łańcucha lekkiego miozyny (MLCK), która z kolei fosforyluje ten łańcuch lekki, aktywuje miozynę i wyzwala proces skurczu..
Wzrost Ca ++ następuje poprzez jego wejście z zewnątrz lub wyjście z siateczki sarkoplazmatycznej przez działanie trifosforanu inozytolu (IP3) uwalnianego przez fosfolipazę C w kaskadzie aktywowanej przez receptory sprzężone z białkiem Gq. Relaksacja występuje, gdy Ca ++, w wyniku działania transporterów, jest usuwany z cytozolu i powraca do miejsc pochodzenia.
Istotną różnicą między oboma typami skurczów jest to, że w mięśniach poprzecznie prążkowanych (sercowych i szkieletowych) Ca ++ indukuje zmiany allosteryczne poprzez wiązanie się ze swoim białkiem troponiną, podczas gdy w mięśniach gładkich zmiany wywoływane przez kalmodulinę Ca są kowalencyjne i obejmują fosforylację miozyny.
Dlatego po zakończeniu działania Ca ++ do usunięcia fosforanu dodanego przez kinazę wymagany jest udział innego enzymu. Ten nowy enzym to fosfataza łańcucha lekkiego miozyny (MLCP), której aktywność nie zależy od kalmoduliny, ale jest regulowana przez inne szlaki.
W rzeczywistości proces skurczu mięśni gładkich nie ustaje całkowicie, ale stopień skurczu pozostaje na poziomie pośrednim w wyniku równowagi działania obu enzymów, MLCK kontrolowanego przez Ca ++ i kalmodulinę oraz MLCP poddawane innym kontrolom regulacyjnym.
Adaptacja w czujnikach węchowych
Wrażenie zapachowe jest wyzwalane, gdy aktywowane są receptory węchowe zlokalizowane w rzęskach komórek znajdujących się na powierzchni śluzówki węchowej..
Te receptory są sprzężone z heterotrimerycznym białkiem G znanym jako „Golf” (węchowe białko G), które ma trzy podjednostki: „αolf”, „ß” i „γ”..
Kiedy receptory węchowe są aktywowane w odpowiedzi na zapach, podjednostki tego białka dysocjują, a podjednostka „αolf” aktywuje enzym cyklazę adenylową, wytwarzając cykliczny monofosforan adenozyny (cAMP)..
CAMP aktywuje kanały podobne do CNG (aktywowane przez cykliczne nukleotydy) dla wapnia i sodu. Jony te wnikają do komórki, depolaryzują ją i powodują inicjację potencjałów czynnościowych, których częstotliwość będzie determinować intensywność zapachu..
Wchodzący do komórki wapń, który ma tendencję do depolaryzacji komórki, ma działanie antagonistyczne w postaci negatywnego sprzężenia zwrotnego, nieco później, wiążąc się z kalmoduliną i zamykając kanał między nimi i eliminując bodziec depolaryzujący, mimo że bodziec zapachowy utrzymuje się. Nazywa się to adaptacją czujnika.
Kalmodulina w roślinach
Rośliny reagują również na różnice w wewnątrzkomórkowym stężeniu jonów wapnia za pośrednictwem kalmoduliny białka. W tych organizmach kalmoduliny mają wiele cech strukturalnych i funkcjonalnych ze swoimi odpowiednikami u zwierząt i drożdży, chociaż różnią się one pod pewnymi względami funkcjonalnymi..
Na przykład kalmodulina w roślinach wiąże się z krótkimi sekwencjami peptydów w obrębie ich docelowych białek, wywołując zmiany strukturalne, które zmieniają ich aktywność w odpowiedzi na wewnętrzne wahania wapnia..
To, w jakim stopniu kalmodulina kontroluje procesy analogiczne do tych, które zachodzą u zwierząt w roślinach, pozostaje dziś przedmiotem dyskusji..
Bibliografia
- Brenner B: Musculatur, w: Fizjologia, 6th ed; R Klinke i in. (Red.). Stuttgart, Georg Thieme Verlag, 2010.
- Ganong WF: Cellular & Molecular Basis of Medical Physiology, w: Przegląd fizjologii medycznej, 25th ed. Nowy Jork, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Introduction to endocrinology, w: Podręcznik fizjologii medycznej, 13 edycja, AC Guyton, JE Hall (red.). Filadelfia, Elsevier Inc., 2016.
- Kaup UB, Müller F: Olfactorisches System, In: Physiologie, 4. wyd .; P Deetjen i in. (Red.). Monachium, Elsevier GmbH, Urban & Fischer, 2005.
- Korbmacher C, Greger R, Brenner B, Silbernagl S: Die Zelle als Grundbaustein, w: Fizjologia, 6th ed; R Klinke i in. (Red.). Stuttgart, Georg Thieme Verlag, 2010.
- Zieliński, R. E. (1998). Białka wiążące kalmodulinę i kalmodulinę u roślin. Coroczny przegląd biologii roślin, 49 (1), 697-725.


Jeszcze bez komentarzy