
Wzory pochłonięte ciepłem, jak to obliczyć i rozwiązane ćwiczenia
Plik pochłonięte ciepło Definiuje się go jako transfer energii między dwoma ciałami w różnych temperaturach. Ten o niższej temperaturze pochłania ciepło tego o wyższej temperaturze. Kiedy tak się dzieje, energia cieplna substancji, która pochłania ciepło, wzrasta, a cząsteczki, które ją tworzą, wibrują szybciej, podnosząc swoją energię kinetyczną..
Może to spowodować wzrost temperatury lub zmianę stanu. Na przykład zmień stan stały w ciekły, taki jak lód, gdy topi się w kontakcie z wodą lub sodą w temperaturze pokojowej.

Dzięki upałowi istnieje również możliwość zmiany wymiarów obiektów. Rozszerzalność termiczna jest dobrym przykładem tego zjawiska. Gdy większość substancji jest podgrzewana, zwykle następuje wzrost ich wymiarów.
Wyjątkiem jest woda. Taka sama ilość wody w stanie ciekłym zwiększa swoją objętość, gdy schłodzi się poniżej 4 ºC. Ponadto zmiany temperatury mogą również ulegać zmianom w jej gęstości, co jest również bardzo widoczne w przypadku wody..
Indeks artykułów
- 1 Z czego się składa i wzory
- 1.1 Kalorie
- 2 Jak to obliczyć?
- 2.1 Bilans energetyczny
- 3 Ćwiczenie rozwiązane
- 3.1 Podejście
- 3.2 Dane
- 4 Odnośniki
Z czego się składa i formuły
W przypadku energii w ruchu jednostkami pochłoniętego ciepła są dżule. Jednak przez długi czas ciepło miało swoje własne jednostki: kalorie.
Nawet dzisiaj ta jednostka jest używana do ilościowego określania wartości energetycznej żywności, chociaż w rzeczywistości kaloria dietetyczna odpowiada kilokalorii ciepła.
Kalorie
Kaloria, w skrócie Limonka, to ilość ciepła potrzebna do podniesienia temperatury 1 grama wody o 1 ° C.
W XIX wieku Sir James Prescott Joule (1818-1889) przeprowadził słynny eksperyment, w którym udało mu się przekształcić pracę mechaniczną w ciepło, uzyskując następującą równoważność:
1 kaloria = 4,186 dżuli
W jednostkach brytyjskich jednostka ciepła nazywa się Btu (Brytyjska jednostka termiczna), która jest definiowana jako ilość ciepła potrzebna do podniesienia temperatury funta wody o 1ºF.
Równoważność między jednostkami jest następująca:
1 Btu = 252 kalorie
Problem z tymi starszymi jednostkami polega na tym, że ilość ciepła zależy od temperatury. Oznacza to, że temperatura wymagana do przejścia z 70ºC do 75ºC nie jest tym samym, co na przykład wymagana do podgrzania wody z 9ºC do 10ºC..
Dlatego definicja uwzględnia dobrze zdefiniowane zakresy: od 14,5 do 15,5 ° C i 63 do 64 ° F odpowiednio dla kalorii i Btu..
Od czego zależy ilość wchłoniętego ciepła?
Ilość pochłanianego ciepła przez materiał zależy od kilku czynników:
- Masa. Im większa masa, tym więcej ciepła jest w stanie wchłonąć.
- Charakterystyka substancji. Istnieją substancje, które w zależności od ich struktury cząsteczkowej lub atomowej są w stanie pochłonąć więcej ciepła niż inne..
- Temperatura. Aby uzyskać wyższą temperaturę, konieczne jest dodanie większej ilości ciepła.
Ilość ciepła oznaczona jako Q, jest proporcjonalna do opisanych czynników. Dlatego można go zapisać jako:
Q = m.c.ΔT
Gdzie m jest masą obiektu, do to ciągłe wezwanie ciepło właściwe, wewnętrzną właściwość substancji oraz ΔT to zmiana temperatury osiągana przez pochłanianie ciepła.
ΔT = T.fa - Tlub
Ta różnica ma pozytywny znak, ponieważ przy pochłanianiu ciepła tego się oczekuje Tfa > Tlub. Dzieje się tak, chyba że substancja przechodzi przemianę fazową, na przykład przechodzenie wody z cieczy w parę. Kiedy woda wrze, jej temperatura utrzymuje się na stałym poziomie około 100ºC, niezależnie od tego, jak szybko się zagotuje..
Jak to obliczyć?
Stykając dwa obiekty o różnych temperaturach, po pewnym czasie oba osiągają równowagę termiczną. Następnie temperatury wyrównują się i ustaje wymiana ciepła. To samo dzieje się, gdy zetkną się więcej niż dwa obiekty. Po pewnym czasie wszystkie będą miały tę samą temperaturę.
Zakładając, że stykające się przedmioty tworzą układ zamknięty, z którego nie może wydostawać się ciepło, obowiązuje zasada zachowania energii, można więc stwierdzić, że:
Q zaabsorbowany = - Q wydany
Stanowi to bilans energetyczny podobny do dochodu i wydatków danej osoby. Z tego powodu przenoszone ciepło ma znak ujemny, ponieważ dla obiektu, który się poddaje, temperatura końcowa jest niższa niż początkowa. W związku z tym:
ΔT = T.fa - Tlub < 0
Równanie Q. zaabsorbowany = - Q wydany jest używany, gdy dwa obiekty stykają się.
Balans energetyczny
Aby przeprowadzić bilans energetyczny, należy odróżnić obiekty, które pochłaniają ciepło, od tych, które go oddają, a następnie:
Σ Qk= 0
Oznacza to, że suma zysków i strat energii w systemie zamkniętym musi wynosić 0.
Ciepło właściwe substancji
Aby obliczyć ilość pochłoniętego ciepła, konieczne jest poznanie ciepła właściwego każdej uczestniczącej substancji. Jest to ilość ciepła potrzebna do podniesienia temperatury 1 g materiału o 1ºC. Jego jednostki w układzie międzynarodowym to: dżul / kg. K..
Istnieją tabele z ciepłem właściwym wielu substancji, zwykle obliczanym za pomocą kalorymetru lub podobnych narzędzi..
Przykład obliczenia ciepła właściwego materiału
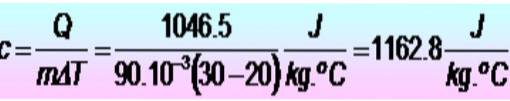
Do podniesienia temperatury metalowego pierścienia z 20 do 30 ºC potrzeba 250 kalorii. Jeśli pierścień ma masę 90 g. Jakie jest ciepło właściwe metalu w jednostkach SI??
Rozwiązanie
Jednostki są konwertowane jako pierwsze:
Q = 250 kalorii = 1046,5 J
m = 90 g = 90 x 10-3 kg
Ćwiczenie rozwiązane
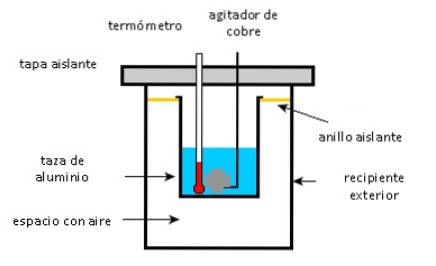
Kubek aluminiowy zawiera 225 g wody i 40 g miedzianego mieszadła, wszystko w temperaturze 27 ° C. 400 g próbkę srebra o początkowej temperaturze 87 ° C umieszcza się w wodzie.
Mieszadło służy do mieszania mieszaniny, aż do osiągnięcia końcowej temperatury równowagi 32 ° C. Oblicz masę kubka aluminiowego, biorąc pod uwagę, że nie ma strat ciepła do otoczenia.
Podejście
Jak wspomniano powyżej, ważne jest, aby odróżnić obiekty oddające ciepło od tych, które pochłaniają:
- Aluminiowy kubek, miedziane mieszadło i woda pochłaniają ciepło.
- Próbka srebra daje ciepło.
Dane
Dostarczane są określone rodzaje ciepła dla każdej substancji:
- Srebro: c = 234 J / kg. ºC
- Miedź: c = 387 J / kg. ºC
- Aluminium c = 900 J / kg. ºC
- Woda c = 4186 J / kg. ºC
Ciepło pochłonięte lub przekazane przez każdą substancję oblicza się za pomocą równania:
Q = m.c. λT
Rozwiązanie
Srebro
Q wydany = 400 x 10 -3 . 234 x (32 - 87) J = -5148 J
Mieszadło miedziane
Q zaabsorbowany = 40 x 10 -3 . 387 x (32 - 27) J = 77,4 J
woda
Q zaabsorbowany = 225 x 10 -3 . 4186 x (32 - 27) J = 4709,25 J
Kubek aluminiowy
Q zaabsorbowany = m aluminium . 900 x (32 - 27) J = 4500 m aluminium
Korzystanie z:
Σ Qk= 0
77,4 + 4709,25 + 4500. M aluminium = - (-5148)
W końcu masa aluminium jest oczyszczona:
m aluminium = 0,0803 kg = 80,3 g
Bibliografia
- Giancoli, D. 2006. Fizyka: Zasady z zastosowaniami. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fizyka: spojrzenie na świat. 6ta Wydanie skrócone. Cengage Learning. 156-164.
- Rex, A. 2011. Podstawy fizyki. Osoba. 309 - 332.
- Sears, Zemansky. 2016. Fizyka uniwersytecka z fizyką współczesną. 14th. Tom 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Podstawy fizyki. 9na Cengage Learning. 362 - 374



Jeszcze bez komentarzy