
Struktura węglanu wapnia, właściwości, tworzenie, zastosowanie
Plik węglan wapnia jest związkiem nieorganicznym, którego wzór chemiczny to CaCO3. Występuje głównie w minerałach, takich jak kalcyt i aragonit. Tworzy również wapień, skałę osadową, w której występuje kalcyt mineralny..
Ten ważny węglan metalu jest uzyskiwany przemysłowo poprzez ekstrakcję i mielenie zawartych w nim minerałów; W tym celu stosuje się głównie marmur. Inny proces polega na zastosowaniu tlenku wapnia, który przekształca się w wodorotlenek wapnia, wytrącając z niego węglan wapnia przez dodanie dwutlenku węgla. W ten sposób uzyskuje się kryształy o szerokiej gamie rozmiarów..

Można je również stosować do przemysłowej produkcji CaCO3, na małą skalę, muszle małży, jaja i ostrygi, w których występuje.
Węglan wapnia obecny w wapieniu jest rozpuszczany w wodzie przez dwutlenek węgla, tworząc wodorowęglan wapnia. To działanie może spowodować powstanie jaskiń i jest przyczyną alkalizacji wody; wydarzenie o wielkim znaczeniu dla utrzymania w nim życia.
Był używany do budowy i wykonywania rzeźb; przykładami tego są Partenon w Atenach, Katedra Krakowska czy rzeźba Abrahama Lincolna w Waszyngtonie. Jednak jego podatność na kwaśne deszcze zmniejszyła jego zastosowanie w budownictwie..
Węglan wapnia ma wiele zastosowań w przemyśle jako wypełniacz do tworzyw sztucznych i papieru. W medycynie był stosowany do kontrolowania kwaśności soku żołądkowego; jako suplement diety w wapń; do kontrolowania fosfatemii u pacjentów z przewlekłą niewydolnością nerek itp..
Indeks artykułów
- 1 Struktura
- 1.1 Twardość białka
- 2 Właściwości
- 2.1 Inne nazwy
- 2.2 Masa molowa
- 2.3 Opis fizyczny
- 2.4 Smak
- 2.5 Temperatura topnienia i wrzenia
- 2.6 Rozpuszczalność
- 2.7 Gęstość
- 2.8 Rozkład
- 2,9 pH
- 2.10 Współczynnik załamania światła
- 2.11 Niezgodności
- 2.12 Entalpia fuzji
- 2.13 Iloczyn rozpuszczalności
- 2.14 Twardość
- 2.15 Przejścia fazowe
- 2.16 Reaktywność
- 3 Szkolenie
- 4 Formy węglanu wapnia
- 5 zastosowań
- 5.1 Przemysłowe
- 5.2 Lekarze
- 5.3 Inne
- 6 Odnośniki
Struktura
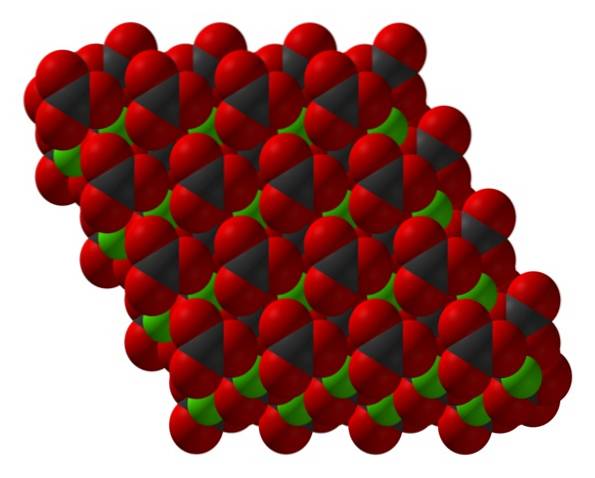
Formuła węglanu wapnia, CaCO3, wskazuje, że stosunek jonów Cadwa+ i CO3dwa- wynosi 1: 1; to znaczy dla każdego Cadwa+ jest CO3dwa- odpowiednik oddziałujący z nim elektrostatycznie. W ten sposób wiązanie jonowe kończy się układaniem tych jonów w celu utworzenia strukturalnych wzorów, które definiują kryształ..
Górny obraz przedstawia strukturę CaCO3. Zielone kule odpowiadają kationom Cadwa+, a czerwone i czarne kule do anionów CO3dwa-. Zwróć uwagę, że struktura wydaje się składać z wielu warstw: jednej z wapnia, a drugiej z węglanu; co oznacza, że krystalizuje w zwartą strukturę heksagonalną.
Ta faza heksagonalna (β-CaCO3) odpowiada polimorfowi. Są jeszcze dwa inne: rombowy (λ-CaCO3) i jeszcze gęstszy heksagonalny (μ-CaCO3). Poniższy obrazek pomaga lepiej zobrazować szczęśliwy sześciokąt:
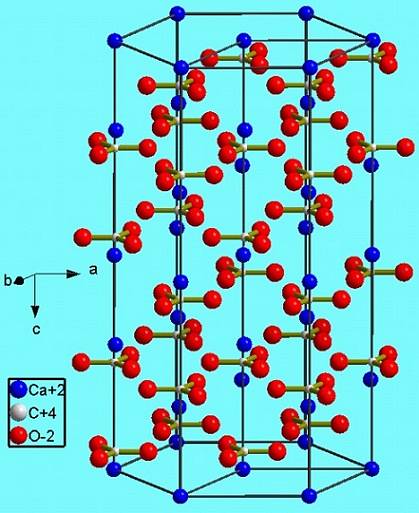
Jednak w zależności od temperatury (a dla tej soli w mniejszym stopniu ciśnienia) jony w swoich drganiach dostosowują się do innych struktur; są to już wspomniane polimorfy (β, λ i μ).
Jak brzmią, nie są zbyt dobrze znane, chyba że zostaną wspomniane z ich nazwami mineralogicznymi w przyszłej sekcji.
Twardość białka
Kryształy CaCO3 Nie są same: mogą zawierać zanieczyszczenia, takie jak inne kationy metali, które je zabarwiają; lub białka, zawierające organiczną matrycę, która w jakiś sposób przyczynia się do jej naturalnej twardości.
Białka zmniejszają napięcie, które kryształy doświadczają przeciwko sobie pod naciskiem lub uderzeniem. W jaki sposób? Po umieszczeniu pomiędzy kryształami, zachowując się jak „podkładka” (podobnie do zestawu cegła-cement-cegła).
Dlatego ten związek lub minerał jest biokompatybilny i nie jest zaskakujące, że jest częścią paznokci, muszelek, muszli lub kości jeży. Jest źródłem inspiracji dla tych, którzy są oddani opracowywaniu nowych materiałów.
Nieruchomości
Inne nazwy
-Aragonit
-Kalcyt
-Volterito
-Mleko wapniowe
-Biała tablica
-Marmur
Masa cząsteczkowa
100,086 g / mol.
Opis fizyczny
Bezwonny biały proszek.
Smak
Podobny do kredy, bez smaku.
Temperatura topnienia i wrzenia
Rozkłada się w wyniku uwolnienia COdwa zanim jeszcze się rozpuści lub zagotuje.
Rozpuszczalność
Praktycznie nierozpuszczalny w wodzie i alkoholu. Rozpuszcza się musująco w rozcieńczonym kwasie octowym i solnym. Jednak wodorotlenki zmniejszają jego rozpuszczalność. Tymczasem sole amonowe i dwutlenek węgla zwiększają rozpuszczalność węglanu wapnia w wodzie..
Gęstość
2,7 do 2,95 g / cm3.
Rozkład
W temperaturze około 825 ° C rozkłada się na tlenek wapnia (wapno) i dwutlenek węgla (COdwa).
pH
8 do 9
Współczynnik załamania światła
-1,7216 przy 300 nm i 1,6584 przy 589 nm (kalcyt).
-1,5145 przy 300 nm i 1,4864 przy 589 nm (aragonit).
Niezgodności
Z kwasami, ałunem i solami amonowymi.
Entalpia fuzji
36 kJ / mol przy 800 ºC (kalcyt).
Stała iloczynu rozpuszczalności
3,36 10-9 przy 25 ºC.
Twardość
-3,0 (kalcyt)
-3,5 - 4,0 (aragonit) w skali Mohsa.
Przejścia fazowe
Aragonit jest metastabilny i nieodwracalnie zmienia się w kalcyt po podgrzaniu w suchym powietrzu w temperaturze 400ºC..
Reaktywność
Węglan wapnia reaguje z kwasami, uwalniając dwutlenek węgla, jonowy wapń i wodę..
Węglan wapnia łączy się z wodą nasyconą dwutlenkiem węgla, odpowiednikiem kwasu węglowego (HdwaWSPÓŁ3), tworząc wodorowęglan wapnia.
Trening
Kreda, marmur i wapień, dwa pierwsze minerały, a trzeci materiał skalny, zawierają węglan wapnia i są pochodzenia osadowego i uważa się, że powstały w wyniku sedymentacji ślimaków na przestrzeni milionów lat..
PH może być najważniejszym czynnikiem w tworzeniu się polimorfów w temperaturze 24ºC. Vaterite jest głównym produktem w zakresie pH od 8,5 do 10; aragonit ma pH 11; i kalcyt przy pH> 12.
Wiadomo również, że wiele glonów słodkowodnych buduje kryształy kalcytu, gdy rośnie w środowisku nasyconym wapniem. Ponadto mikroalgi mogą powodować wytrącanie się węglanu wapnia.
Formy węglanu wapnia
Poniższe obrazy pokazują trzy główne formy lub polimorfy węglanu wapnia:



Od góry do dołu są polimorfami kalcyt, aragonit i wateryt. Zwróć uwagę na pierwszy rzut oka różnicę między morfologią kryształów (kolor jest typowy dla jego pochodzenia i cech otoczenia).
Waterit jest bardziej nieprzezroczysty niż kalcyt, ten ostatni staje się nawet całkowicie przezroczysty (islandzki drzewc) i dlatego był używany w biżuterii i zastosowaniach optycznych. Tymczasem kryształy aragonitu przypominają małe, wydłużone monolity.
Gdyby pod mikroskopem elektronowym obserwować próbki tych trzech polimorfów, ich kryształy (z szarawymi tonami ze względu na fakt, że technika nie pozwala na rozdzielanie kolorów), można by znaleźć te same morfologie, co w skalach makroskopowych; to znaczy na pierwszy rzut oka.
Spośród tych trzech polimorfów kalcyt jest najbardziej rozpowszechniony i stabilny, a następnie aragonit, a na końcu wateryt, najrzadsza z form CaCO.3
Aplikacje
Przemysłowy
Węglan wapnia zwiększa odporność na skręcanie i rozciąganie kauczuku syntetycznego i naturalnego, zachowując jego elastyczność. Znajduje zastosowanie w budownictwie jako składnik cementu oraz jako surowiec do wapna. Jego użycie zostało ograniczone, ponieważ jest niszczony przez kwaśne deszcze.
Węglan wapnia jest używany do oczyszczania żelaza. W postaci wapna usuwa dwutlenek siarki obecny w metalu. Służy do oczyszczania cukru buraczanego. Kiedyś była używana jako kreda tablicowa, ale do tego zastosowania została zastąpiona tynkiem.
Węglan wapnia miesza się z kitem używanym przy montażu szkła. Mielony jest używany jako materiał wypełniający w mikroporowatej folii stosowanej w pieluchach. Jest również stosowany jako materiał wypełniający w tworzywach sztucznych, takich jak PVC. Dodatkowo zwiększa wytrzymałość tworzywa.
Węglan wapnia służy do zwiększenia zdolności krycia farb. Jest używany jako materiał wypełniający papier, ponieważ jest tańszy niż włókno drzewne i może stanowić ponad 10% papieru.
Lekarze
Jest stosowany jako środek zobojętniający kwas w celu zwalczania nadkwasoty żołądka i łagodzenia niestrawności. Stosowany jest jako suplement diety w wapń oraz w leczeniu i profilaktyce osteoporozy. Stosowany jest w leczeniu hiperfosfatemii u pacjentów z przewlekłą niewydolnością nerek..
Stosowano go w celu zmniejszenia działań niepożądanych inhibitorów proteazy stosowanych w leczeniu HIV, przy czym obserwowano zmniejszenie biegunki u pacjentów..
Powoduje obniżenie ciśnienia krwi u kobiet w ciąży z nadciśnieniem i stanem przedrzucawkowym, ponieważ oba mogą być związane ze zwiększonym zapotrzebowaniem na wapń z powodu obecności płodu.
Inni
Węglan wapnia jest stosowany w rolnictwie jako nawóz oraz do zwalczania zakwaszenia gleby. Jest stosowany jako środek konserwujący, utrwalający kolor i ujędrniający żywność.
Ponadto jest składnikiem pasty do zębów, służy jako środek ścierny w postaci proszku do czyszczenia i mycia..
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). Mc Graw Hill.
- Wikipedia. (2019). Węglan wapnia. Odzyskane z: en.wikipedia.org
- Narodowe Centrum Informacji Biotechnologicznej. (2019). Węglan wapnia. Baza danych PubChem., CID = 10112. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Kai-Yin Chong, Chin-Hua Chia i Sarani Zakaria. (2014). Polimorfy węglanu wapnia na reakcję temperaturową. AIP Conference Proceedings 1614, 52; doi.org/10.1063/1.4895169
- Greg Watry. (1 listopada 2016). Odkrywanie, jak kryształy węglanu wapnia nabierają siły. Marketing biznesowy Advantage. Odzyskany z: rdmag.com
- Elementy amerykańskie. (2019). Węglan wapnia. Odzyskany z: americanelements.com
- ElSevier. (2019). Węglan wapnia. ScienceDirect. Odzyskany z: sciencedirect.com
- Książka chemiczna. (2017). Węglan wapnia. Odzyskane z: chemicalbook.com



Jeszcze bez komentarzy