
Właściwości węgla, struktura, otrzymywanie, zastosowania
Plik węgiel Jest to niemetaliczny pierwiastek chemiczny o symbolu chemicznym C. Swoją nazwę zawdzięcza węglowi, roślinom lub minerałom, których atomy określają różne struktury. Wielu autorów określa go mianem króla pierwiastków, ponieważ tworzy szeroką gamę związków organicznych i nieorganicznych, a także występuje w znacznej liczbie alotropów..
A jeśli nie wystarczy nazywać go szczególnym elementem, występuje on we wszystkich żywych istotach; wszystkie jego biocząsteczki zawdzięczają swoje istnienie stabilności i sile wiązań C-C oraz ich dużej skłonności do łączenia się. Węgiel jest pierwiastkiem życia, a wraz z jego atomami budowane są ich ciała.

Związki organiczne, z których zbudowane są biomateriały, składają się praktycznie ze szkieletów węglowych i heteroatomów. Można je zobaczyć gołym okiem w lesie drzew; a także, gdy uderza w nie piorun i piecze. Pozostałe obojętne czarne ciało stałe również zawiera węgiel; ale chodzi o węgiel drzewny.
Istnieją zatem „martwe” przejawy tego pierwiastka: węgiel drzewny, produkt spalania w środowiskach ubogich w tlen; oraz węgiel mineralny, produkt procesów geologicznych. Obie substancje stałe wyglądają podobnie, są czarne i spalają się, aby wytworzyć ciepło i energię; chociaż z różnymi plonami.
Od tego momentu węgiel jest 15. najbardziej rozpowszechnionym pierwiastkiem w skorupie ziemskiej. Nic dziwnego, że rocznie produkuje się miliony ton węgla. Minerały te różnią się właściwościami w zależności od stopnia zanieczyszczenia, stawiając antracyt jako węgiel mineralny najwyższej jakości..
Skorupa ziemska jest nie tylko bogata w węgiel mineralny, ale także w węglany, zwłaszcza wapień i dolomity. A jeśli chodzi o Wszechświat, jest to czwarty najobficiej występujący element; Chodzi mi o to, że na innych planetach jest więcej węgla.
Indeks artykułów
- 1 Historia węgla
- 1.1 Patrząc wstecz
- 1.2 Uznanie
- 2 Właściwości
- 2.1 Grafit a diament
- 3 Struktura i konfiguracja elektroniczna
- 3.1 Hybrydyzacje
- 3.2 stopnie utlenienia
- 3.3 Geometrie molekularne
- 3.4 Amorficzne lub krystaliczne ciała stałe
- 4 Otrzymywanie
- 5 zastosowań
- 6 Zagrożenia i środki ostrożności
- 7 Referencje
Historia węgla
Retrospekcja
Węgiel może być tak stary jak sama skorupa ziemska. Od niepamiętnych czasów starożytne cywilizacje napotykały ten pierwiastek w wielu jego naturalnych postaciach: sadza, węgiel drzewny, węgiel drzewny, węgiel drzewny, diamenty, grafit, smoła węglowa, antracyt itp..
Wszystkie te bryły, mimo że miały wspólne ciemne odcienie (z wyjątkiem diamentu), reszta ich właściwości fizycznych, a także skład, różniły się znacząco. Wtedy nie można było twierdzić, że składają się one głównie z atomów węgla.
W ten sposób w historii węgiel klasyfikowano według jego jakości podczas spalania i dostarczania ciepła. Wraz z gazami powstałymi w wyniku jego spalania podgrzewały się masy wody, które z kolei wytwarzały opary, które poruszały turbinami wytwarzającymi prądy elektryczne..
Węgiel był nieoczekiwanie obecny w węglu drzewnym wytwarzanym przez spalanie drzew w zamkniętych lub hermetycznych przestrzeniach; w graficie, z którego wykonano ołówki; w diamentach używanych jako klejnoty; był odpowiedzialny za twardość stali.
Jego historia idzie w parze z drewnem, prochem strzelniczym, gazami oświetleniowymi miast, pociągami i statkami, piwem, smarami i innymi przedmiotami niezbędnymi dla rozwoju ludzkości..
Uznanie
W którym momencie naukowcy byli w stanie skojarzyć alotropy i minerały węgla z tym samym pierwiastkiem? Węgiel był postrzegany jako minerał i nie był uważany za pierwiastek chemiczny godny układu okresowego. Pierwszym krokiem powinno być pokazanie, że wszystkie te ciała stałe zostały przekształcone w ten sam gaz: dwutlenek węgla, COdwa.
Antoine Lavoisier w 1772 roku, używając drewnianej oprawki z dużymi soczewkami, skupił promienie słoneczne na próbkach węgla drzewnego i diamentu. Odkrył, że żaden z nich nie tworzył oparów wody, ale COdwa. Zrobił to samo z sadzą i uzyskał takie same wyniki..
Carl Wilhelm Scheele w 1779 r. Odkrył związek chemiczny między węglem drzewnym a grafitem; to znaczy, że obie ciała stałe składały się z tych samych atomów.
Smithson Tennant i William Hyde Wollaston w 1797 roku metodologicznie zweryfikowali (poprzez reakcje), że diament rzeczywiście składa się z węgla przez wytwarzanie COdwa w jego spalaniu.
Dzięki tym wynikom światło zostało wkrótce rzucone na grafit i diament, ciała stałe utworzone przez węgiel, a zatem o wysokiej czystości; w przeciwieństwie do zanieczyszczonych ciał stałych węgla i innych minerałów zawierających węgiel.
Nieruchomości
Fizyczne lub chemiczne właściwości ciał stałych, minerałów lub materiałów zawierających węgiel zależą od wielu zmiennych. Wśród nich są: skład lub stopień zanieczyszczeń, hybrydyzacje atomów węgla, różnorodność struktur oraz morfologia lub wielkość porów..
Kiedy opisywane są właściwości węgla, większość tekstów lub źródeł bibliograficznych opiera się na graficie i diamentie..
Dlaczego? Ponieważ są to najlepiej znane alotropy dla tego pierwiastka i reprezentują ciała stałe lub materiały o wysokiej czystości; to znaczy, że są praktycznie zbudowane tylko z atomów węgla (chociaż mają różne struktury, jak zostanie wyjaśnione w następnej sekcji).
Właściwości węgla drzewnego i mineralnego różnią się odpowiednio pochodzeniem lub składem. Na przykład węgiel brunatny (niskowęglowy) jako paliwo pełznie w porównaniu z antracytem (wysokowęglowym). A co z innymi alotropami: nanorurkami, fulerenami, grafenami, graffinami itp..
Jednak pod względem chemicznym mają jedną wspólną cechę: utleniają się z nadmiarem tlenu w COdwa:
do + LUBdwa => COdwa
Teraz prędkość lub temperatura, których wymagają do utleniania, są specyficzne dla każdego z tych alotropów..
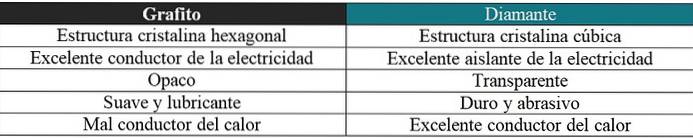
Grafit vs diament
Zostanie tu również zamieszczony krótki komentarz dotyczący bardzo różnych właściwości tych dwóch odmian alotropowych:
Struktura i konfiguracja elektroniczna
Hybrydyzacje
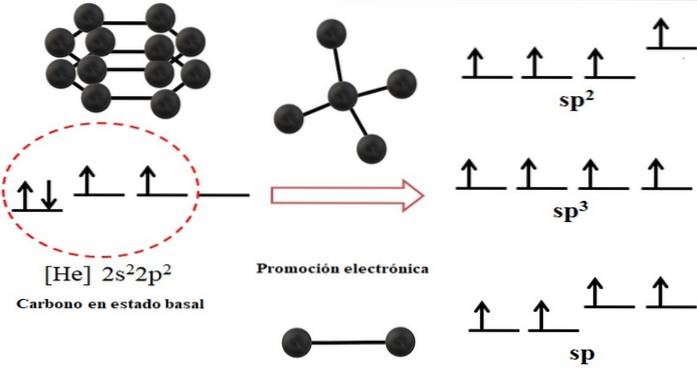
Konfiguracja elektronowa atomu węgla to 1sdwa2sdwa2 Pdwa, również napisane jako [He] 2sdwa2 Pdwa (górne zdjęcie). Ta reprezentacja odpowiada swojemu stanowi podstawowemu: atom węgla odizolowany i zawieszony w takiej próżni, że nie może wchodzić w interakcje z innymi..
Można zauważyć, że jeden z jego orbitali 2p nie ma elektronów, które przyjmują elektron z orbity o niższej energii 2s poprzez promocję elektroniczną; w ten sposób atom uzyskuje zdolność tworzenia do czterech wiązań kowalencyjnych poprzez swoje cztery orbitale hybrydowe sp3.
Zauważ, że cztery orbitale sp3 są zdegenerowane pod względem energii (wyrównane na tym samym poziomie). Orbitale p czyste są bardziej energetyczne, dlatego znajdują się nad innymi orbitaliami hybrydowymi (po prawej stronie obrazu).
Jeśli istnieją trzy orbitale hybrydowe, dzieje się tak dlatego, że pozostaje jeden orbital p bez hybrydyzacji; dlatego są to trzy orbitale spdwa. A kiedy są dwa z tych orbitali hybrydowych, dwa orbitale p są dostępne do tworzenia wiązań podwójnych lub potrójnych, będących hybrydyzacją węgla sp.
Takie aspekty elektroniczne są niezbędne do zrozumienia, dlaczego węgiel można znaleźć w nieskończoności alotropów..
Liczby utleniania
Zanim przejdziemy dalej do struktur, warto o tym wspomnieć, biorąc pod uwagę konfigurację elektronów walencyjnych 2sdwa2 Pdwa, węgiel może mieć następujące stopnie utlenienia: +4, +2, 0, -2 i -4.
Dlaczego? Liczby te odpowiadają założeniu, że istnieje takie wiązanie jonowe, że tworzysz jony z odpowiednimi ładunkami; to znaczy C4+, dodwa+, do0 (neutralny), C.dwa- i C4-.
Aby węgiel miał dodatni stopień utlenienia, musi stracić elektrony; i aby to zrobić, musi być koniecznie związany z atomami bardzo elektroujemnymi (takimi jak tlen).
Tymczasem, aby węgiel miał ujemny stopień utlenienia, musi pozyskiwać elektrony poprzez wiązanie z atomami metalu lub mniej elektroujemnymi niż on (np. Wodór).
Pierwszy stopień utlenienia +4 oznacza, że węgiel stracił wszystkie elektrony walencyjne; orbitale 2s i 2p pozostają puste. Jeśli orbital 2p straci swoje dwa elektrony, węgiel będzie miał stopień utlenienia +2; jeśli zdobędziesz dwa elektrony, będziesz miał -2; a jeśli zdobędziesz jeszcze dwa elektrony, uzupełniając swój oktet walencyjny, -4.
Przykłady
Na przykład dla COdwa stopień utlenienia węgla wynosi +4 (ponieważ tlen jest bardziej elektroujemny); podczas gdy dla CH4, wynosi -4 (ponieważ wodór jest mniej elektroujemny).
Dla CH3OH, stopień utlenienia węgla wynosi -2 (+1 dla H i -2 dla O); podczas gdy dla HCOOH jest to +2 (sprawdź, czy suma daje 0).
Prawdopodobne są również inne stany utlenienia, takie jak -3 i +3, zwłaszcza jeśli chodzi o cząsteczki organiczne; na przykład w grupach metylowych -CH3.
Geometrie molekularne
Górny obraz pokazał nie tylko hybrydyzację orbitali atomu węgla, ale także wynikającą z tego geometrię molekularną, gdy kilka atomów (czarnych kul) zostało połączonych z jednym centralnym. Aby ten centralny atom miał określone środowisko geometryczne w przestrzeni, musi mieć odpowiednią hybrydyzację chemiczną, która na to pozwala..
Na przykład dla czworościanu centralny węgiel ma hybrydyzację sp3; ponieważ taki jest najbardziej stabilny układ dla czterech orbitali hybrydowych sp3. W przypadku węgli spdwa, mogą tworzyć wiązania podwójne i mieć środowisko płaszczyzny trygonalnej; i tak te trójkąty definiują idealny sześciokąt. A dla hybrydyzacji sp węgle przyjmują geometrię liniową.
Zatem geometrie obserwowane w strukturach wszystkich odmian alotropowych są po prostu regulowane w czworościanach (sp3), sześciokątów lub pięciokątów (spdwa) i linie (sp).
Czworościany określają strukturę 3D, podczas gdy sześciokąty, pięciokąty i linie, struktury 3D lub 2D; Te ostatnie to płaszczyzny lub arkusze podobne do ścian plastrów miodu:

A jeśli złożymy tę sześciokątną ścianę (pięciokątną lub mieszaną), otrzymamy rurkę (nanorurki) lub kulkę (fulereny) lub inną figurę. Interakcje między tymi figurami prowadzą do różnych morfologii.
Amorficzne lub krystaliczne ciała stałe
Pomijając geometrie, hybrydyzacje lub morfologie możliwych struktur węgla, jego ciała stałe można globalnie podzielić na dwa typy: amorficzne lub krystaliczne. Pomiędzy tymi dwoma klasyfikacjami rozmieszczone są ich alotropy.
Węgiel amorficzny to po prostu taki, który przedstawia dowolną mieszaninę czworościanów, sześciokątów lub linii, niezdolnych do ustalenia wzoru strukturalnego; tak jest w przypadku węgla, węgla drzewnego lub węgla aktywnego, koksu, sadzy itp..
Podczas gdy krystaliczny węgiel składa się z wzorów strukturalnych utworzonych przez dowolną z proponowanych geometrii; na przykład diament (trójwymiarowa sieć czworościanów) i grafit (ułożone w stos arkusze sześciokątne).
Otrzymywanie
Węgiel może być czysty jak grafit lub diament. Znajdują się one w odpowiednich złożach mineralogicznych rozsianych po całym świecie iw różnych krajach. Dlatego niektóre kraje są bardziej eksporterami jednego z tych minerałów niż inne. Krótko mówiąc, „musisz wykopać ziemię”, aby uzyskać węgiel.
To samo dotyczy węgla mineralnego i jego rodzajów. Ale tak nie jest w przypadku węgla drzewnego, ponieważ ciało bogate w węgiel musi najpierw „zginąć” pod wpływem ognia lub pioruna elektrycznego; oczywiście w przypadku braku tlenu, w przeciwnym razie zostałby uwolniony COdwa.
Cały las jest źródłem węgla, takim jak węgiel drzewny; nie tylko ze względu na drzewa, ale także na faunę.
Ogólnie rzecz biorąc, próbki zawierające węgiel muszą zostać poddane pirolizie (spalaniu pod nieobecność tlenu), aby uwolnić część zanieczyszczeń w postaci gazów; a zatem ciało stałe bogate w węgiel (bezpostaciowe lub krystaliczne) pozostaje jako pozostałość.
Aplikacje
Ponownie, podobnie jak właściwości i struktura, zastosowania lub zastosowania są zgodne z alotropami lub mineralogicznymi formami węgla. Istnieją jednak pewne kwestie ogólne, o których można wspomnieć, poza kilkoma dobrze znanymi kwestiami. Są to:
-Węgiel był od dawna stosowany jako mineralny środek redukujący do otrzymywania czystych metali; na przykład między innymi żelazo, krzem i fosfor.
-Jest kamieniem węgielnym życia, a badaniami tej refleksji są chemia organiczna i biochemia..
-Było to również paliwo kopalne, które pozwoliło pierwszym maszynom na zmianę biegów. Podobnie pozyskiwano z niego gaz węglowy do starych systemów oświetleniowych. Węgiel był synonimem światła, ciepła i energii.
-Zmieszany jako dodatek z żelazem w różnych proporcjach, pozwolił na wynalezienie i udoskonalenie stali.
-Jego czarny kolor miał miejsce w sztuce, zwłaszcza w graficie i wszystkich pismach wykonanych jego pociągnięciami..
Ryzyko i środki ostrożności
Węgiel i jego ciała stałe nie stanowią żadnego zagrożenia dla zdrowia. Kto kiedykolwiek przejmował się workiem węgla drzewnego? Są sprzedawane w wielu miejscach w korytarzach niektórych rynków i dopóki nie będzie w pobliżu ognia, ich czarne bloki nie spłoną..
Z drugiej strony koks może stanowić zagrożenie, jeśli zawiera wysoką zawartość siarki. Podczas spalania uwalnia gazy siarkowe, które oprócz działania toksycznego, przyczyniają się do powstawania kwaśnych deszczy. I chociaż COdwa w małych ilościach nie może nas udusić, wywiera ogromny wpływ na środowisko jako gaz cieplarniany.
Z tej perspektywy węgiel jest zagrożeniem „długoterminowym”, ponieważ jego spalanie zmienia klimat naszej planety..
W sensie bardziej fizycznym ciała stałe lub materiały zawierające węgiel, jeśli są sproszkowane, są łatwo transportowane przez prądy powietrza; w konsekwencji są wprowadzane bezpośrednio do płuc, co może je nieodwracalnie uszkodzić.
Co do reszty, bardzo często spożywa się „węgiel drzewny”, gdy coś jest gotowane.
Bibliografia
- Morrison, R. T. and Boyd, R, N. (1987). Chemia organiczna. Wydanie 5. Od redakcji Addison-Wesley Interamericana.
- Carey F. (2008). Chemia organiczna. (Wydanie szóste). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Chemia organiczna. Aminy. (Wydanie 10.). Wiley plus.
- Andrzej. (2019). Węgiel, jego alotropy i struktury. Odzyskany z: everyscience.com
- Advameg, Inc. (2019). Węgiel. Wyjaśnienie chemii. Odzyskany z: chemistryexplained.com
- Helmenstine, dr Anne Marie (11 lipca 2018). 10 faktów dotyczących węgla (liczba atomowa 6 lub C). Odzyskany z: thinkco.com
- Tawnya Eash. (2019). Co to jest węgiel? - Fakty i lekcja historii dla dzieci. Nauka. Odzyskany z: study.com
- Föll. (s.f.). Historia węgla. Odzyskany z: tf.uni-kiel.de



Jeszcze bez komentarzy