
Struktura kwasu siarkowego, właściwości, nazewnictwo, zastosowania
Plik kwas siarkowy to tlenokwas, który powstaje w wyniku rozpuszczenia dwutlenku siarki, SOdwa, w wodzie. Jest słabym i niestabilnym kwasem nieorganicznym, którego nie wykryto w roztworze, ponieważ reakcja jego powstania jest odwracalna, a kwas szybko rozkłada się w odczynnikach, które go wytworzyły (SOdwa i HdwaLUB).
Cząsteczka kwasu siarkowego była dotychczas wykrywana tylko w fazie gazowej. Sprzężone zasady tego kwasu są powszechnymi anionami w postaci siarczynów i wodorosiarczynów..
południowy zachóddwa + H.dwaLUB <=> HSO3- + H.+
Wskazuje to, że przy użyciu widma Ramana nie można wykryć obecności kwasu siarkowego w roztworze dwutlenku siarki w wodzie..
Wystawiony na działanie atmosfery szybko przekształca się w kwas siarkowy. Kwas siarkowy jest redukowany do siarkowodoru pod działaniem rozcieńczonego kwasu siarkowego i cynku.
Próba skoncentrowania rozwiązania systemu operacyjnegodwa poprzez odparowanie wody w celu uzyskania bezwodnego kwasu siarkowego nie przyniosło rezultatów, ponieważ kwas rozkłada się szybko (odwracając reakcję tworzenia), więc nie można go wyodrębnić.
Indeks artykułów
- 1 Naturalna formacja
- 2 Struktura
- 2.1 Wyizolowana cząsteczka
- 2.2 Cząsteczka otoczona wodą
- 2,3 SO2 ∙ nH2O
- 3 Właściwości fizyczne i chemiczne
- 3.1 Wzór cząsteczkowy
- 3.2 Masa cząsteczkowa
- 3.3 Wygląd fizyczny
- 3.4 Gęstość
- 3.5 Gęstość par
- 3.6 Korozyjność
- 3.7 Rozpuszczalność w wodzie
- 3.8 Czułość
- 3.9 Stabilność
- 3.10 stała kwasowości (Ka)
- 3,11 pKa
- 3,12 pH
- 3.13 Temperatura zapłonu
- 3.14 Rozkład
- 4 Nazewnictwo
- 5 Synteza
- 6 zastosowań
- 6.1 W drewnie
- 6.2 Środek dezynfekujący i wybielający
- 6.3 Środek konserwujący
- 6.4 Inne zastosowania
- 7 Referencje
Naturalna formacja
Kwas siarkowy powstaje w naturze w wyniku połączenia dwutlenku siarki, produktu działalności dużych fabryk, z wodą atmosferyczną. Z tego powodu uważany jest za produkt pośredni kwaśnych deszczy, powodujący ogromne szkody w rolnictwie i środowisku..
Jego forma kwaśna nie nadaje się do użytku w przyrodzie, ale zwykle wytwarza się go w postaci soli, siarczynu i wodorosiarczynu sodu i potasu..
Siarczyn jest wytwarzany endogennie w organizmie w wyniku metabolizmu aminokwasów zawierających siarkę. Podobnie siarczyn jest wytwarzany jako produkt fermentacji żywności i napojów. Siarczyn ma właściwości alergizujące, neurotoksyczne i metaboliczne. Jest metabolizowany przez enzym oksydazę siarczynową, który przekształca go w siarczan, nieszkodliwy związek.
Struktura
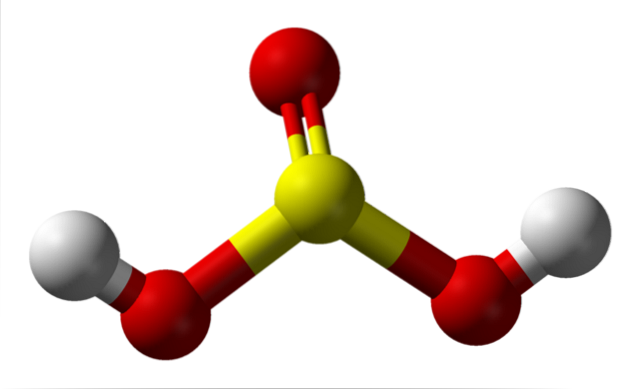
Izolowana cząsteczka
Na zdjęciu widać strukturę wyizolowanej cząsteczki kwasu siarkowego w stanie gazowym. Żółta sfera w środku odpowiada atomowi siarki, czerwona - atomom tlenu, a biała - atomom wodoru. Jego geometria molekularna wokół atomu S to trójkątna piramida, której podstawę stanowią atomy O.
Następnie w stanie gazowym cząsteczki H.dwapołudniowy zachód3 można traktować jako małe, trygonalne piramidy unoszące się w powietrzu, zakładając, że jest wystarczająco stabilne, aby przetrwać chwilę bez reagowania.
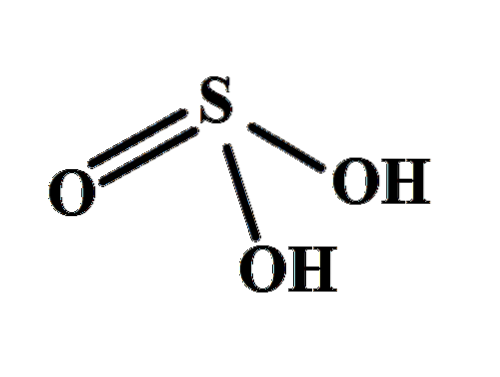
Struktura wyjaśnia, skąd pochodzą dwa kwaśne atomy wodoru: z wiązanych siarką grup hydroksylowych HO-SO-OH. Dlatego w przypadku tego związku nie można zakładać, że jeden z kwaśnych protonów, H+, jest uwalniany z atomu siarki, H-SOdwa(O).
Dwie grupy OH pozwalają kwasowi siarkowemu oddziaływać poprzez wiązania wodorowe, a ponadto tlen wiązania S = O jest akceptorem wodoru, który przekształca Hdwapołudniowy zachód3 zarówno dobrym dawcą, jak i akceptorem tych mostów.
Zgodnie z powyższym Hdwapołudniowy zachód3 powinien móc skraplać się do postaci cieczy, tak jak robi to kwas siarkowy, H.dwapołudniowy zachód4. Niemniej jednak tak się nie dzieje.
Cząsteczka otoczona wodą
Do tej pory nie było możliwe otrzymanie bezwodnego kwasu siarkowego, czyli H.dwapołudniowy zachód3(l); podczas gdy H.dwapołudniowy zachód4(ac) natomiast po odwodnieniu przekształca się w postać bezwodną, H.dwapołudniowy zachód4(l), który jest gęstą i lepką cieczą.
Jeśli przyjmie się, że cząsteczka Hdwapołudniowy zachód3 pozostaje niezmieniony, wtedy będzie w stanie w dużym stopniu rozpuścić się w wodzie. Oddziaływaniami, które będą rządzić we wspomnianych roztworach wodnych, będą ponownie wiązania wodorowe; Jednak oddziaływania elektrostatyczne mogłyby również istnieć w wyniku równowagi hydrolizy:
H.dwapołudniowy zachód3(ac) + HdwaO (l) <=> HSO3-(ac) + H3LUB+(ac)
HSO3-(ac) + HdwaO (l) <=> południowy zachód3dwa-(ac) + H3LUB+
Jon siarczynowy, SO3dwa- Byłaby to ta sama cząsteczka, co powyżej, ale bez białych kulek; i jon wodorosiarczynowy (lub wodorosiarczynowy), HSO3-, zachowuje białą kulę. Nieskończoności soli mogą powstawać z obu anionów, niektórych bardziej niestabilnych niż innych.
W rzeczywistości potwierdzono, że niezwykle mała część rozwiązań składa się z H.dwapołudniowy zachód3; to znaczy, wyjaśniona cząsteczka nie jest tą, która oddziałuje bezpośrednio z cząsteczkami wody. Powodem tego jest to, że ulega on rozkładowi powodującemu SOdwa i HdwaLub, który jest preferowany termodynamicznie.
południowy zachóddwa∙nHdwaLUB
Prawdziwa struktura kwasu siarkowego składa się z cząsteczki dwutlenku siarki otoczonej kulą wody złożoną z n cząsteczek..
Zatem SOdwa, którego budowa jest kanciasta (typ bumerangu), wraz z jej wodnistą kulką odpowiada za kwaśne protony charakteryzujące kwasowość:
południowy zachóddwa∙ nHdwaO (ac) + HdwaO (l) <=> H.3LUB+(ac) + HSO3-(ac) + nHdwaO (l)
HSO3-(ac) + HdwaO (l) <=> południowy zachód3dwa-(ac) + H3LUB+
Oprócz tej równowagi istnieje również równowaga rozpuszczalności SOdwa, którego cząsteczka może uciec z wody do fazy gazowej:
południowy zachóddwa(sol) <=> południowy zachóddwa(ac)
Fizyczne i chemiczne właściwości
Formuła molekularna
H.dwapołudniowy zachód3
Waga molekularna
82,073 g / mol.
Wygląd fizyczny
Jest to bezbarwna ciecz o ostrym zapachu siarki.
Gęstość
1,03 g / ml.
Gęstość pary
2,3 (w odniesieniu do powietrza przyjętego jako 1)
Korozyjność
Działa korodująco na metale i tkaniny.
Rozpuszczalność w wodzie
Mieszalny z wodą.
Wrażliwość
Jest wrażliwy na powietrze.
Stabilność
Stabilny, ale niekompatybilny z mocnymi zasadami.
Stała kwasowości (Ka)
1,54 x 10-dwa
pKa
1.81
pH
1,5 w skali pH.
punkt zapłonu
Niepalny.
Rozkład
Po podgrzaniu kwas siarkowy może się rozkładać, wydzielając toksyczny dym tlenku siarki..
Nomenklatura
Siarka ma następujące wartościowości: ± 2, +4 i +6. Ze wzoru H.dwapołudniowy zachód3, można obliczyć wartościowość lub liczbę utleniania siarki w związku. Aby to zrobić, po prostu rozwiąż sumę algebraiczną:
2 (+1) + 1v + 3 (-2) = 0
Ponieważ jest to związek obojętny, suma ładunków atomów, które go tworzą, musi wynosić 0. Rozwiązując v dla poprzedniego równania otrzymujemy:
v = (6-2) / 1
Zatem v jest równe +4. Oznacza to, że siarka uczestniczy z drugą wartościowością i zgodnie z tradycyjną nomenklaturą do nazwy należy dodać przyrostek -oso. Z tego powodu w H.dwapołudniowy zachód3 jest znany jako kwas siarkowyNiedźwiedź.
Innym szybszym sposobem określenia tej wartościowości jest porównanie H.dwapołudniowy zachód3 z Hdwapołudniowy zachód4. W Hdwapołudniowy zachód4 siarka ma wartościowość +6, więc jeśli usuniemy O, wartościowość spadnie do +4; a jeśli usunie się inny, wartościowość spadnie do +2 (co miałoby miejsce w przypadku kwasu czkawkasiarkaNiedźwiedź, H.dwapołudniowy zachóddwa).
Chociaż mniej znany, dla H.dwapołudniowy zachód3 Można go również nazwać kwasem trioksosiarkowym (IV), zgodnie z nomenklaturą zapasów.
Synteza
Technicznie powstaje przez spalanie siarki w celu wytworzenia dwutlenku siarki. To następnie rozpuszcza się w wodzie, tworząc kwas siarkowy. Jednak reakcja jest odwracalna i kwas szybko rozkłada się z powrotem na reagenty..
To jest wyjaśnienie, dlaczego kwas siarkowy nie występuje w roztworze wodnym (jak już wspomniano w części dotyczącej jego budowy chemicznej).
Aplikacje

Ogólnie rzecz biorąc, zastosowania i zastosowania kwasu siarkowego, ponieważ jego obecności nie można wykryć, odnoszą się do zastosowań i zastosowań roztworów dwutlenku siarki oraz zasad i soli kwasu..
W lesie
W procesie siarczynowym miazga drzewna produkowana jest w postaci prawie czystych włókien celulozowych. Do ekstrakcji ligniny z zrębków drzewnych używa się różnych soli kwasu siarkowego, przy użyciu naczyń wysokociśnieniowych zwanych digistorami..
Sole używane w procesie otrzymywania miazgi drzewnej to siarczyn (SO3dwa-) lub wodorosiarczyn (HSO3-), w zależności od pH. Przeciwjonem może być Na+, ACdwa+, K.+ lub NH4+.
Środek dezynfekujący i wybielający
-Jako środek dezynfekujący stosowany jest kwas siarkowy. Jest również stosowany jako łagodny środek wybielający, szczególnie w przypadku materiałów wrażliwych na chlor. Ponadto znajduje zastosowanie jako wybielacz zębów oraz dodatek do żywności.
-Jest składnikiem różnych kosmetyków do pielęgnacji skóry i był stosowany jako pestycyd przy eliminacji szczurów. Usuwa plamy spowodowane winem lub owocami na różnych tkaninach.
-Służy jako środek antyseptyczny, skutecznie zapobiegając infekcjom skóry. W niektórych momentach był używany do fumigacji do dezynfekcji statków, rzeczy chorych ofiar epidemii itp..
Środek konserwujący
Kwas siarkowy jest stosowany jako środek konserwujący do owoców i warzyw oraz do zapobiegania fermentacji napojów, takich jak wino i piwo, będąc pierwiastkiem przeciwutleniającym, przeciwbakteryjnym i grzybobójczym..
Inne zastosowania
-Kwas siarkowy jest używany do syntezy leków i chemikaliów; w produkcji wina i piwa; rafinacja produktów naftowych; i jest używany jako odczynnik analityczny.
-Wodosiarczyn reaguje z nukleozydami pirymidynowymi i dodaje się do podwójnego wiązania między pozycją 5 i 6 pirymidyny, modyfikując wiązanie. Transformacja wodorosiarczynem służy do badania drugorzędowych lub wyższych struktur polinukleotydów.
Bibliografia
- Wikipedia. (2018). Kwas siarkowy. Odzyskane z: en.wikipedia.org
- Nazewnictwo kwasów. [PDF]. Źródło: 2.chemistry.gatech.edu
- Voegele F. Andreas i kol. (2002). O stabilności kwasu siarkowego (H.dwapołudniowy zachód3) i jego Dimer. Chem. Eur. J. 2002. 8, nr 24.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Wydanie czwarte, str. 393). Mc Graw Hill.
- Calvo Flores F. G. (s.f.). Preparat chemii nieorganicznej. [PDF]. Odzyskany z: ugr.es
- PubChem. (2018). Kwas siarkowy. Odzyskany z: pubchem.ncbi.nlm.nih.gov
- Steven S. Zumdahl. (15 sierpnia 2008). Oxyacid. Encyclopædia Britannica. Odzyskany z: britannica.com


Jeszcze bez komentarzy