
Czynniki kinetyki chemicznej, kolejność i zastosowania reakcji
Plik Kinetyka chemiczna Jest to badanie szybkości reakcji. Wyprowadzaj dane doświadczalne lub teoretyczne na temat mechanizmu molekularnego za pomocą praw wyrażonych równaniami matematycznymi. Mechanizmy składają się z szeregu kroków, z których niektóre są szybkie, a inne wolne..
Najwolniejszy z nich nazywany jest krokiem wyznaczającym prędkość. Dlatego znajomość gatunków pośrednich i mechanizmu działania tego etapu jest bardzo ważna z punktu widzenia kinetyki. Wizualizacja powyższego polega na założeniu, że odczynniki są zamknięte w butelce i że podczas reakcji produkty wydostają się na zewnątrz.

Wreszcie produkty swobodnie wychodzą z ust butelki bez dalszych przeszkód kinetycznych. Z tej perspektywy istnieją butelki o wielu rozmiarach i wzorach. Jednak wszystkie mają jeden wspólny element: wąską szyjkę, wskaźnik decydującego etapu reakcji..
Indeks artykułów
- 1 Co bada kinetyka chemiczna?
- 2 Szybkość reakcji
- 2.1 Definicja
- 2.2 Ogólne równanie
- 2.3 Przykład deseru
- 2.4 Jak to ustalić
- 3 Czynniki wpływające na szybkość reakcji
- 3.1 Charakter gatunków chemicznych
- 3.2 Stężenie odczynników
- 3.3 Temperatura
- 4 Kolejność reakcji w kinetyce chemicznej
- 4.1 Reakcje zerowego rzędu
- 4.2 Reakcja pierwszego rzędu
- 4.3 Reakcja drugiego rzędu
- 4.4 Kolejność reakcji a molekularność
- 5 Aplikacje
- 6 Odnośniki
Co bada kinetyka chemiczna?
Eksperymentalnie ta gałąź chemii bada zmiany stężeń zachodzące w reakcji chemicznej na podstawie pomiaru określonej właściwości.
Kinetyka chemiczna to dziedzina chemii odpowiedzialna za badanie wszystkich informacji, które można uzyskać na podstawie szybkości reakcji. Jego nazwa zachęca do wyobrażenia sobie zegarka kieszonkowego, który wyznacza czas procesu, niezależnie od tego, gdzie on zachodzi: w reaktorze, w chmurze, w rzece, w ludzkim ciele itp..
Wszystkie reakcje chemiczne, a zatem i wszystkie przemiany, mają aspekty termodynamiczne, równowagowe i kinetyczne. Termodynamika wskazuje, czy reakcja jest spontaniczna, czy nie; waga - stopień kwantyfikacji; i kinetyka warunki, które sprzyjają jego szybkości, a także dane o jego mechanizmie.
Wiele istotnych aspektów kinetyki chemicznej można zaobserwować w życiu codziennym: w lodówce, która zamraża żywność, aby zmniejszyć jej rozkład, zamrażając wodę, która jest jej częścią. Również podczas dojrzewania win, których dojrzewanie nadaje im przyjemny smak.
Jednak „czas cząsteczek” jest bardzo różny w swoich małych skalach i różni się ogromnie w zależności od wielu czynników (liczba i typy wiązań, rozmiary, stany skupienia itp.).
Ponieważ czas to życie, a także pieniądze, wiedza o tym, które zmienne pozwalają na jak najszybszy przebieg reakcji chemicznej, jest sprawą najwyższej wagi. Czasami jednak pożądane jest odwrotne: reakcja zachodzi bardzo wolno, zwłaszcza jeśli jest egzotermiczna i istnieje ryzyko wybuchu.
Co to za zmienne? Niektóre są fizyczne, np. Przy jakim ciśnieniu lub temperaturze powinien mieć reaktor lub system; a inne są chemiczne, takie jak rodzaj rozpuszczalnika, pH, zasolenie, struktura molekularna itp..
Jednak zanim znajdziemy te zmienne, musimy najpierw zbadać kinetykę obecnej reakcji.
W jaki sposób? Poprzez zmiany stężenia, które można śledzić, jeśli określona właściwość, która jest proporcjonalna do pierwszej, jest określona ilościowo. W całej historii metody stały się bardziej wyrafinowane, umożliwiając dokładniejsze i precyzyjniejsze pomiary w coraz krótszych odstępach czasu..
Szybkość reakcji
Aby określić szybkość reakcji chemicznej, należy wiedzieć, jak zmienia się w czasie stężenie któregokolwiek z zaangażowanych gatunków. Szybkość ta zależy w dużej mierze od wielu czynników, ale najważniejsze jest to, że jest ona mierzalna dla tych reakcji, które zachodzą „wolno”.
Tutaj słowo „powoli” jest względne i jest zdefiniowane dla wszystkiego, co można zmierzyć za pomocą dostępnych technik instrumentalnych. Jeśli na przykład reakcja jest znacznie szybsza niż możliwości pomiarowe sprzętu, to nie będzie to ilościowe ani nie można zbadać jej kinetyki..
Następnie szybkość reakcji jest określana na progu dowolnego procesu, zanim osiągnie on równowagę. Dlaczego? Ponieważ w równowadze prędkość reakcji w przód (tworzenie produktu) i reakcji odwrotnej (tworzenie reagentów) są takie same.
Kontrolując zmienne, które oddziałują na system, a co za tym idzie, jego kinetykę lub szybkość reakcji, można dobrać idealne warunki do wytworzenia określonej ilości produktu w najbardziej pożądanym i bezpiecznym czasie..
Z drugiej strony wiedza ta ujawnia mechanizm molekularny, który jest cenny przy zwiększaniu wydajności reakcji..
Definicja
Prędkość to zmiana wielkości w funkcji czasu. W przypadku tych badań zainteresowanie polega na określeniu zmian stężenia w miarę upływu godzin i minut; nano, pico, a nawet femtosekundy (10-piętnaścies).
Możesz mieć wiele jednostek, ale najprostszym i najłatwiejszym ze wszystkich jest M s-1, lub co jest równe mol / l · s. Niezależnie od swoich jednostek, zawsze powinien mieć wartość dodatnią, ponieważ jest to wielkość fizyczna (taka jak wymiary lub masa).
Jednak zgodnie z konwencją wskaźniki znikania reagenta mają znak ujemny, a występowanie produktu - znak dodatni..
Ale jeśli reagenty i produkty mają swoje własne prędkości, to jak określić ogólną szybkość reakcji? Odpowiedź tkwi we współczynnikach stechiometrycznych.
Ogólne równanie
Następujące równanie chemiczne wyraża reakcję A i B w celu utworzenia C i D:
doDO + bB => dodo + rere
Stężenia molowe są zwykle wyrażane w nawiasach kwadratowych, więc na przykład stężenie gatunku A jest zapisywane jako [A]. Zatem szybkość reakcji dla każdego z zaangażowanych związków chemicznych wynosi:
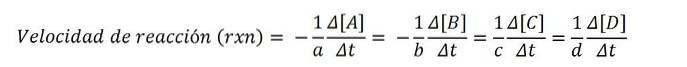
Zgodnie z równaniem matematycznym istnieją cztery drogi osiągnięcia szybkości reakcji: mierzona jest zmiana stężenia dowolnego z reagentów (A lub B) lub produktów (C lub D)..
Następnie jedną z tych wartości i jej prawidłowym współczynnikiem stechiometrycznym podziel przez tę ostatnią i otrzymamy szybkość reakcji rxn.
Ponieważ szybkość reakcji jest wielkością dodatnią, znak ujemny mnoży ujemne wartości szybkości reagentów; z tego powodu współczynniki do Y b pomnóż przez (-1).
Na przykład, jeśli szybkość znikania A wynosi - (5 M / s), a jego współczynnik stechiometryczny do wynosi 2, więc prędkość rxn jest równa 2,5 M / s ((-1/2) x 5).
Przykład deseru

Gdyby produkt był deserem, analogicznie składniki byłyby odczynnikami; a równanie chemiczne, przepis:
7Ciasteczka + 3 Brownie + 1 Lody => 1 Deser
A prędkości dla każdego ze słodkich składników i samego deseru są następujące:
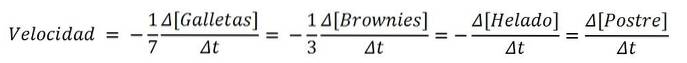
W ten sposób szybkość, z jaką przygotowywany jest deser, można określić za pomocą odmian ciastek, ciastek, lodów lub samego zestawu; a następnie podzielenie go przez współczynniki stechiometryczne (7, 3, 1 i 1). Jednak jedna z tras może być łatwiejsza niż druga..
Na przykład, jeśli zmierzysz wzrost [Deser] w różnych odstępach czasu, pomiary te mogą być trudne..
Z drugiej strony pomiar [Ciastek] może być wygodniejszy i bardziej praktyczny ze względu na ich liczbę lub niektóre z ich właściwości, które ułatwiają określenie ich stężenia niż w przypadku ciastek czy lodów..
Jak to ustalić
Biorąc pod uwagę prostą reakcję A => B, jeśli na przykład A w roztworze wodnym wykazuje zielone zabarwienie, to zależy to od jego stężenia. Tak więc, gdy A staje się B, zielony kolor znika, a jeśli to zniknięcie zostanie określone ilościowo, można otrzymać krzywą [A] vs t.
Z drugiej strony, jeśli B jest związkiem kwaśnym, pH roztworu spadnie do wartości poniżej 7. Tak więc ze spadku pH otrzymujemy [B] i kolejno wykres [B] vs t. Następnie nakładając oba wykresy, możemy zobaczyć coś takiego:

Na wykresie możemy zobaczyć, jak [A] maleje z czasem, ponieważ jest zużywane, i jak krzywa [B] rośnie z dodatnim nachyleniem, ponieważ jest to iloczyn.
Można również zauważyć, że [A] dąży do zera (jeśli nie ma równowagi) i że [B] osiąga maksymalną wartość regulowaną przez stechiometrię i jeśli reakcja jest zakończona (cały A jest zużyty).
Szybkość reakcji zarówno A, jak i B to styczna na jednej z tych krzywych; innymi słowy, pochodna.
Czynniki wpływające na szybkość reakcji
Charakter gatunków chemicznych
Gdyby wszystkie reakcje chemiczne były natychmiastowe, ich badania kinetyczne nie istniałyby. Wiele z nich ma tak duże prędkości, że nie można ich zmierzyć; to znaczy, że nie są mierzalne.
Zatem reakcje między jonami są zwykle bardzo szybkie i całkowite (z wydajnością około 100%). Z drugiej strony te, w których występują związki organiczne, wymagają czasu. Reakcja pierwszego typu to:
H.dwapołudniowy zachód4 + 2NaOH => Nadwapołudniowy zachód4 + 2HdwaLUB
Silne oddziaływania elektrostatyczne między jonami sprzyjają szybkiemu tworzeniu się wody i siarczanu sodu. Zamiast tego reakcją drugiego typu jest np. Estryfikacja kwasu octowego:
CH3COOH + CH3CHdwaOH => CH3COOCHdwaCH3 + H.dwaLUB
Chociaż tworzy się również woda, reakcja nie jest natychmiastowa; nawet w sprzyjających warunkach trwa kilka godzin.
Jednak większy wpływ na szybkość reakcji mają inne zmienne: stężenie reagentów, temperatura, ciśnienie i obecność katalizatorów..
Stężenie odczynników
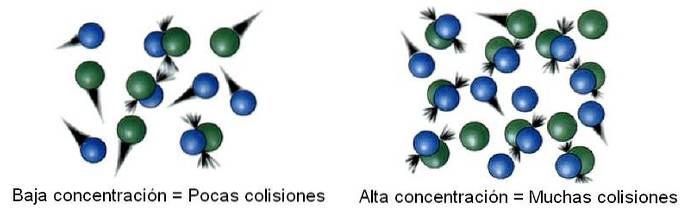
W kinetyce chemicznej badana przestrzeń, oddzielona od nieskończoności, nazywana jest systemem. Na przykład reaktor, zlewkę, kolbę, chmurę, gwiazdę itp. Można uznać za badany system..
Zatem w systemie cząsteczki nie są statyczne, ale raczej „podróżują” do wszystkich jego rogów. W przypadku niektórych z tych przemieszczeń zderza się z inną cząsteczką, aby odbijać się lub wytwarzać produkty..
Wówczas liczba zderzeń jest proporcjonalna do stężenia reagentów. Powyższy obraz ilustruje, jak system zmienia się od niskich do wysokich stężeń.
Ponadto im więcej jest zderzeń, tym szybsza jest reakcja, ponieważ zwiększa się prawdopodobieństwo reakcji dwóch cząsteczek..
Jeśli reagenty są gazowe, wówczas zmienna ciśnienia jest obsługiwana i jest związana ze stężeniem gazu przy założeniu dowolnego z wielu istniejących równań (takich jak równania gazu doskonałego); lub też zmniejsza się objętość układu, aby zwiększyć prawdopodobieństwo zderzenia cząsteczek gazowych.
Temperatura
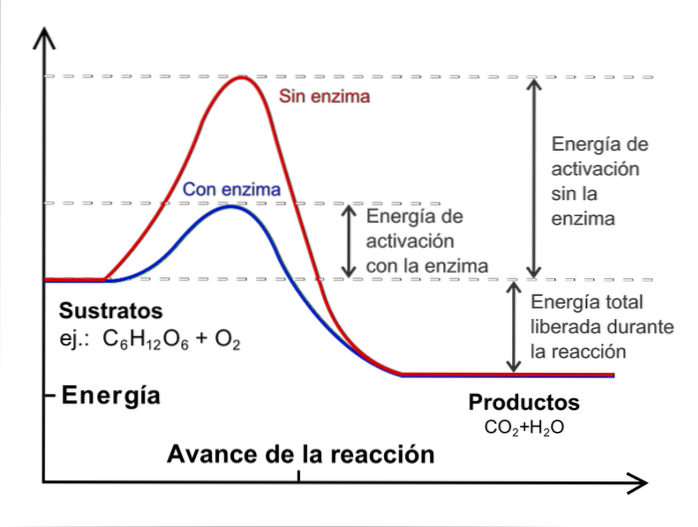
Chociaż liczba zderzeń wzrasta, nie wszystkie cząsteczki mają energię wymaganą do przekroczenia energii aktywacji procesu.
Tutaj temperatura odgrywa ważną rolę: pełni funkcję termicznego przyspieszania cząsteczek, tak aby zderzały się z większą energią..
Zatem szybkość reakcji na ogół podwaja się na każde 10 ° C wzrostu temperatury systemu. Jednak w przypadku wszystkich reakcji nie zawsze tak jest. Jak przewidzieć ten wzrost? Równanie Arrheniusa odpowiada na pytanie:
d (lnK) / dT = E / (RTdwa)
K jest stałą szybkości w temperaturze T, R jest stałą gazową, a E jest energią aktywacji. Ta energia wskazuje na barierę energetyczną, którą reagenty muszą przeskalować, aby zareagować..
W celu przeprowadzenia badania kinetycznego konieczne jest utrzymanie stałej temperatury i bez katalizatorów. Co to są katalizatory? Są gatunkami zewnętrznymi, które interweniują w reakcji, ale nie są konsumowane, co zmniejsza energię aktywacji.
Powyższy obraz ilustruje koncepcję katalizy reakcji glukozy z tlenem. Czerwona linia przedstawia energię aktywacji bez enzymu (katalizatora biologicznego), podczas gdy niebieska linia pokazuje spadek energii aktywacji.
Kolejność reakcji w kinetyce chemicznej
W równaniu chemicznym wskaźniki stechiometryczne związane z mechanizmem reakcji nie są równe indeksom tego samego rzędu. Reakcje chemiczne mają zwykle pierwszy lub drugi rząd, rzadziej trzeci lub wyższy..
Po co to jest? Ponieważ zderzenia trzech wzbudzonych energetycznie cząsteczek są mało prawdopodobne, a tym bardziej zderzenia poczwórne lub pięciokrotne, gdzie prawdopodobieństwo jest nieskończenie małe. Możliwe są również ułamkowe zamówienia reakcji. Na przykład:
NH4Cl <=>NH3 + HCl
Reakcja jest pierwszego rzędu w jednym sensie (od lewej do prawej) i drugiego rzędu w drugim (od prawej do lewej), jeśli jest uważana za równowagę. Podczas gdy następująca równowaga jest drugiego rzędu w obu kierunkach:
2HI <=> H.dwa + jadwa
Czy molekularność i kolejność reakcji są takie same? Nie. Molekularność to liczba cząsteczek, które reagują, tworząc produkty, a ogólna kolejność reakcji jest taka sama, jak w przypadku reagentów biorących udział w etapie określania szybkości..
2KMnO4 + 10KI + 8Hdwapołudniowy zachód4 => 2MnSO4 + 5Idwa + 6Kdwapołudniowy zachód4 + 8HdwaLUB
Ta reakcja, pomimo wysokich wskaźników stechiometrycznych (molekularności), jest w rzeczywistości reakcją drugiego rzędu. Innymi słowy, krok określający prędkość jest drugiego rzędu.
Zero reakcji kolejności
Występują w przypadku reakcji heterogenicznych. Na przykład: między cieczą a ciałem stałym. Zatem prędkość jest niezależna od stężeń reagentów.
Podobnie, jeśli reagent ma rząd reakcji równy zero, oznacza to, że nie bierze udziału w decydującym kroku prędkości, ale w szybkim.
Reakcja pierwszego rzędu
A => B
Reakcja pierwszego rzędu podlega następującym prawom dotyczącym szybkości:
V = k [A]
Jeśli stężenie A podwoi się, szybkość reakcji V podwoi się. Dlatego szybkość jest proporcjonalna do stężenia odczynnika w decydującym etapie reakcji..
Reakcja drugiego rzędu
2A => B.
A + B => C
W tego typu reakcjach biorą udział dwa gatunki, tak jak w dwóch właśnie napisanych równaniach chemicznych. Prawa szybkości reakcji są następujące:
V = k [A]dwa
V = k [A] [B]
W pierwszej szybkość reakcji jest proporcjonalna do kwadratu stężenia A, podczas gdy w drugiej zachodzi to samo, co w reakcjach pierwszego rzędu: szybkość jest wprost proporcjonalna do stężeń zarówno A, jak i B..
Kolejność reakcji a molekularność
Zgodnie z poprzednim przykładem współczynniki stechiometryczne mogą, ale nie muszą, pokrywać się z kolejnością reakcji.
Dzieje się tak jednak w przypadku reakcji elementarnych, które określają mechanizm molekularny dowolnego etapu reakcji. W tych reakcjach współczynniki są równe liczbie uczestniczących cząsteczek.
Na przykład, cząsteczka A reaguje z jednym z B, tworząc cząsteczkę C. Tutaj molekularność wynosi 1 dla reagentów, a następnie w wyrażeniu prawa szybkości pokrywają się one z porządkami reakcji.
Z tego wynika, że molekularność zawsze musi być liczbą całkowitą i prawdopodobnie mniejszą niż cztery.
Dlaczego? Ponieważ w przejściu mechanizmu jest bardzo mało prawdopodobne, aby cztery cząsteczki uczestniczyły w tym samym czasie; dwóch z nich mogłoby zareagować jako pierwsze, a następnie dwie pozostałe zareagowałyby z tym produktem.
Matematycznie jest to jedna z głównych różnic między rzędami reakcji a cząsteczkami: kolejność reakcji może przyjmować wartości ułamkowe (1/2, 5/2 itd.).
Dzieje się tak, ponieważ pierwsza z nich odzwierciedla tylko wpływ koncentracji gatunku na prędkość, a nie sposób, w jaki ich cząsteczki wpływają na ten proces..
Aplikacje
- Pozwala określić czas pozostawania leku w organizmie przed całkowitym metabolizmem. Podobnie, dzięki badaniom kinetycznym, kataliza enzymatyczna może być traktowana jako ekologiczna metoda w porównaniu z innymi katalizatorami o negatywnym wpływie na środowisko; lub również do wykorzystania w niezliczonych procesach przemysłowych.
- W przemyśle motoryzacyjnym, szczególnie w silnikach, gdzie reakcje elektrochemiczne muszą być przeprowadzane szybko, aby pojazd mógł się uruchomić. Również w rurach wydechowych, które mają katalizatory do przekształcania szkodliwych gazów CO, NO i NO.x w COdwa, H.dwaO, Ndwa mniedwa w optymalnym czasie.
2NaN3(s) = 2Na (s) + 3Ndwa(sol)
-Jest to reakcja powodująca, że poduszki powietrzne, czyli „poduszki powietrzne”, napełniają się podczas zderzenia pojazdów. Kiedy opony uderzają w hamulce, detonator elektrycznie detonuje azydek sodu NaN3. Ten odczynnik "wybucha" uwalniając N.dwa, który szybko zajmuje całą objętość worka.
Sód metaliczny reaguje następnie z innymi składnikami, aby go zneutralizować, ponieważ w stanie czystym jest trujący.
Bibliografia
- Walter J. Moore. (1963). Chemia fizyczna. W Kinetyka chemiczna. Wydanie czwarte, Longmans.
- Ira N. Levine. (2009). Zasady fizykochemii. Wydanie szóste, str. 479–540. Mc Graw Hill.
- UAwiki. (23 grudnia 2011). Zderzenia molekularne są. [Postać]. Pobrane 30 kwietnia 2018 z: es.m.wikipedia.org
- Glasstone. (1970). Podręcznik chemii fizycznej. W Kinetyka chemiczna. Druga edycja. D. Van Nostrand, Company, Inc.
- Dr Anne Marie Helmenstine (8 marca 2017). Definicja kinetyki chemicznej. Pobrane 30 kwietnia 2018 r.Z: thinkco.com
- Khan academy. (2018). Współczynniki reakcji i prawa dotyczące szybkości. Pobrane 30 kwietnia 2018 z: khanacademy.org
- Germán Fernández. (26 lipca 2010). Kinetyka chemiczna. Pobrane 30 kwietnia 2018 r.Z: quimicafisica.com



Jeszcze bez komentarzy